Autor: Anna Kurcek
Telomerami (z gr. telos – koniec i meros – część) nazywa się niekodujące – heterochromatynowe domeny zlokalizowane na obu końcach każdego chromosomu. Po raz pierwszy zastały one odkryte w 1938 roku przez Hansa Mullera.
Telomery zbudowane są z tandemowo powtórzonych sekwencji nukleotydowych, połączonych z szeregiem wyspecjalizowanych białek warunkujących ich stabilność i odpowiedni kształt. Dzięki obecności kompleksu ochronnego telomer tworzy wewnętrzne wiązania i formuje dwie pętle: D-loop i T- loop. Struktura ta chroni go przed zniszczeniem oraz niekontrolowanym łączeniem się wolnych końców łańcuchów DNA.
Białka ochronne łączą się bezpośrednio z telomerowym DNA:
• TRF1 i TRF 2 – (ang. telomeric repeat binding factor) – wiążą dwuniciowe łańcuchy;
• POT1 – (ang. protection of telomeres) – wiążą jednoniciowe fragmenty telomeru i odgrywają kluczową rolę przy tworzeniu się pętli D-loop;
lub stabilizują strukturę kompleksu:
• Białka Rap1 – (ang. repressore activator protein);
• TPP1 (znane tez jako TINT1/PIP1/PTOP 1);
• TIN2 (ang. TRF1 interacting nuclear factor).
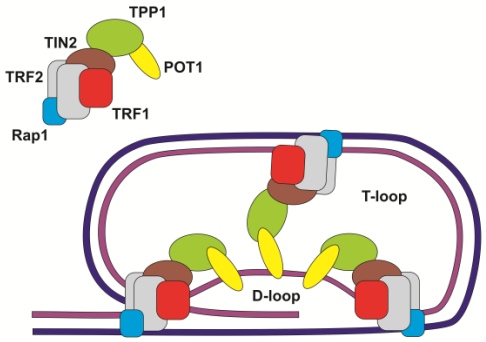
Rys. 1. Budowa telomeru
Zakończenia chromosomów charakteryzują się wysoką konserwatywnością. U człowieka tworzą je heksanukleotydowe odcinki bogate w cytozynę (koniec 5’) lub guaninę (koniec 3’).
Różnice w sekwencji tych fragmentów zwiększają się w kierunku do środka chromosomu. Tzw. obszar subtelomerowy, może zawierać zarówno sekwencje kodujące, jak i niekodujące. Razem z telomerem tworzy on tzw. końcowy fragment restrykcyjny (ang. TRF. terminal restriction fragment), za którym zlokalizowane są pierwsze geny subtelomerowe. Ich aktywność jest maskowana przez długie telomery i uaktywniana wraz z wiekiem.
Długość telomerów nie jest wielkością stałą. To cecha zależna zarówno dla gatunku, osobnika, jak i organu, a nawet pojedynczego chromosomu. Jej określenie stało się możliwe dzięki rozwojowi biologii molekularnej.
Najpopularniejszą techniką jest Southern blot lub inaczej TRF (ang. telomere restriction fragment analysis), w której średnią długość telomerów określa się na podstawie powstałych na żelu prążków. Wymaga ona jednak dużych ilości DNA i dlatego nie nadaje się do przeprowadzania analiz na pojedynczych komórkach lub poszczególnych chromosomach.
Metoda oparta na real-time PCR pozwala przebadać małe ilości DNA. Za jej pomocą można określić stosunek ilości DNA telomerowego do genów referencyjnych (ang. housekeeping genes) i dlatego wykorzystuje się ją jedynie do porównywania wyników wewnątrz jednego gatunku.
Do analizy pojedynczych telomerów wykorzystuje się połączenie obu tych technik, tzn. z pomocą Southern blottingu rozdziela się zamplifikowane produkty PCR. Metoda ta może być jednak stosowana jedynie dla analizy chromosomów, których DNA subtelomerowe zostało dobrze poznane.
Dzięki technikom hybrydyzacyjnym można także uwidocznić telomery w pojedynczych komórkach. W tym celu stosuje się Q-FISH – (ang. quantitative fluorescence in situ hybridization), Flow –FISH (ang. flow fluorescence in situ hybridization) i cytomertię przepływową.
Tab. 1. Długość i sekwencja telomerów u różnych gatunków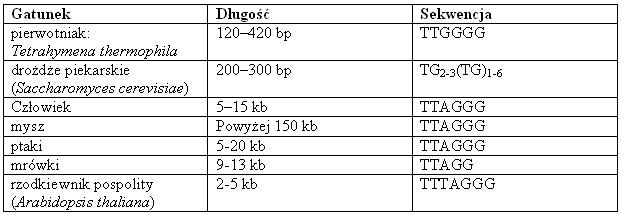
Struktura telomerów zabezpiecza końce chromosomów przed degradacją i ewentualnymi uszkodzeniami powstającymi podczas replikacji. Pozbawione ich chromosomy mogą łączyć się ze sobą w niekontrolowany sposób. Telomery gwarantują zatem stabilność materiału genetycznego, umożliwiają całkowitą replikację chromosomów oraz warunkują ich prawidłowe ustawienie się parami homologicznymi podczas podziałów.
Komórki mogą się dzielić jedynie określoną ilość razy – jest to tzw. limit Hayflicka. Po tym okresie zachodzą zmiany w ich morfologii i ekspresji genów. Proces starzenia się może być powodowany przez wiele czynników. Jednym z nich jest skracanie się telomerów będące wynikiem tzw. problemu replikacji końca. Podczas replikacji polimeraza może poruszać się tylko w jednym kierunku i dlatego nie może kopiować miejsca przyłączenia się terminalnego primera. Usunięcie startera RNA z nici opóźnionej powoduje zatem powstawanie cząsteczki potomnej z niekompletnym końcem 5’. Skrócone telomery tracą zdolność do wiązania niezbędnych białek i tworzenia pętli T (T-loop). W ten sposób powstają wolne końce, które stanowią sygnał do rozpoczęcia apoptozy.
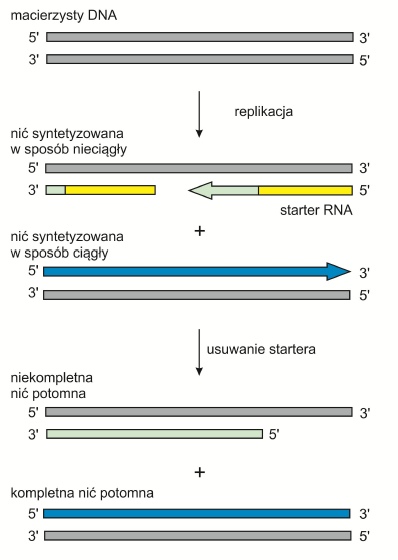
Rys. 2. Problem replikacji końca
Niektóre komórki posiadają enzym zdolny do rekonstrukcji telomerów. Są to ulegające intensywnym podziałom limfocyty, keratynocyty skóry, komórki płciowe i nowotworowe. Wysoką aktywność telomeraza zachowuje również w pluripotencjalnych komórkach macierzystych. Są one niezbędne do utrzymania homeostazy tkankowej, gdyż dają początek nowym komórkom i dzięki temu uzupełniają powstające za życia szkody i ubytki.
Telomeraza jest dużym, złożonym enzymem rybonukleoproteinowym, tj. zbudowanym z RNA i białek. Składa się on z katalitycznej podjednostki o aktywności odwrotnej transkryptazy TERT (ang. telomerase reverse transcriptase), matrycy RNA – TERC (ang. telomerase RNA component) oraz stabilizującego strukturę białka – dyskeryny. Całość wiąże się do końca 3’ nici bogatej w guaninę i dobudowuje do niej terminalny odcinek.
Telomeraza jest wyjątkowo aktywna podczas rozwoju embrionalnego. Jej ekspresja w komórkach somatycznych obniża się jednak w parę tygodni po narodzinach. Z jej mutacjami związane są takie choroby jak: wrodzona dyskeratoza, anemia plastyczna, idiopatyczne włóknienie płuc. Schorzenia te są wynikiem występowania zbyt krótkich i dysfunkcyjnych telomerów.
Możliwa jest również niezależna od telomerazy elongacja telomerów. Proces ten nazywa się alternatywnym wydłużaniem telomerów (ang. alternative lengthening of telomeres – ALT) i zachodzi u ssaków oraz drożdży. Komórki nie posiadające aktywnej telomerazy mogą zatem wydłużać swoje telomery dzięki mechanizmowi rekombinacji.
Literatura:
• Luis E. Donate and Maria A. Blasco “Telomeres in cancer and ageing”, Philos Trans R Soc Lond B Biol Sci. 2011 January 12; 366(1561): 76–84;
• Roderick J. O’Sullivan and Jan Karlseder “Telomeres: protecting chromosomes against genome instability”, Nat Rev Mol Cell Biol. 2010 March; 11(3): 171–181;
• Hisko Oeseburg, Rudolf A. de Boer, Wiek H. van Gilst, and Pim van der Harst “Telomere biology in healthy aging and disease”, Pflugers Arch. 2010 January; 459(2): 259–268;
• Huawei Xin, Dan Liu, Zhou Songyang “The telosome/shelterin complex and its functions”, Genome Biol. 2008; 9(9): 232;
• Lubert Stryer “Biochemia”, Wydawnictwo Naukowe PWN, Warszawa 2003.

