Autor: Paulina Kęska
Korzenie włośnikowate otrzymuje się w wyniku transformacji tkanek roślinnych odpowiednio dobranym szczepem Argobacterium rhizogenes. Jak opisuje literatura bakteria ta skuteczna jest przy zakażaniu roślin dwuliściennych, natomiast rośliny jednoliścienne, tj. np. rośliny cebulowe, trawy czy zboża wykazują znikomą podatność na transformację. W wyniku transformacji przenoszony jest specyficzny fragment DNA. Zbudowany jest on z 10 – 30 tys. par zasad i oznaczany jako T-DNA (transferred DNA). Wchodzi on w skład plazmidu pRI (roots inducing plasmid). Zawarte w nim geny mogą być przeniesione w procesie patogenezy do komórek roślinnych, gdzie następuje ich integracja [Chmiel i inni; 2001]. Proces powstawania korzeni włośnikowatych w wyniku zakażenia A.rhizogenes ukazano poniżej (rys.1).
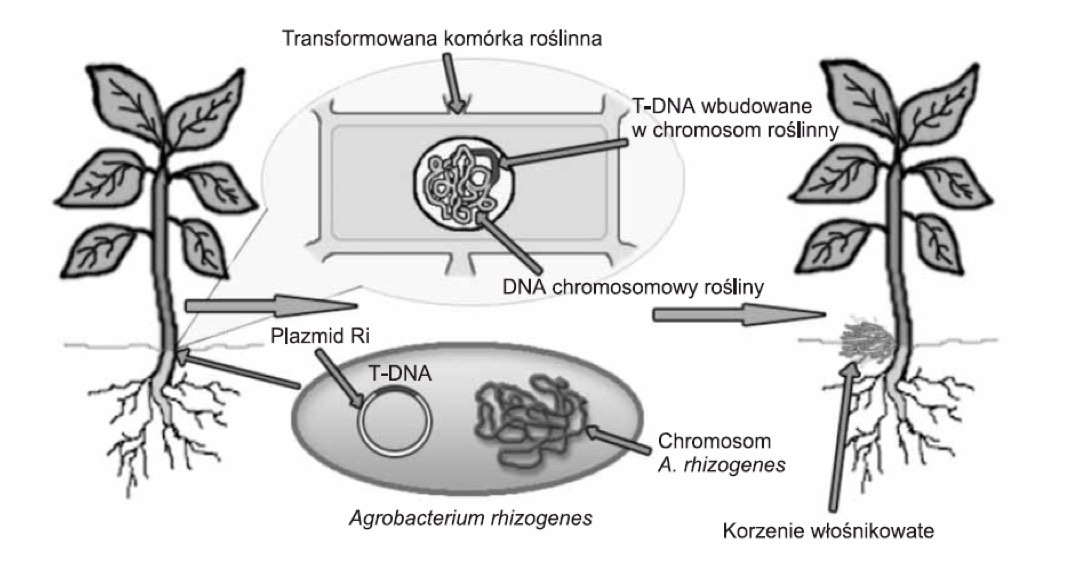
Rysunek 1. Powstawanie korzeni włośnikowatych w wyniku wbudowania fragmentu plazmidu Ri A. Rhizogenes (T-DNA) do genomu roślinnego [Wasilewska, Królicka 2005].
Miejsce infekcji jest kwestią przypadku (losową). Efektem tego procesu jest zmiana programu genetycznego zainfekowanej komórki i w dalszej perspektywie powstawanie korzeni włośnikowatych. W regionie T-DNA zlokalizowane są geny: rola, rolB, rolC, rolD, uważane za niezbędne w formowaniu korzeni włośnikowatych. Efektem ich działania jest wzrost stężenia hormonów roślinnych, co z kolei indukuje podziały komórkowe i prowadzi do tworzenia korzeni włośnikowatych [Wysokińska, Chmiel 2006]. Równocześnie następuje ekspresja genów warunkujących biosyntezę opin [Hnatuszko – Konka i inni, 2009]. Opiny zaliczane są do pochodnych aminokwasów, np. agropina, mannopina, kwas agropinowy, kwas mannopinowy. kukumopina oraz jej stereoizomer – mikimopina. Stanowią one źródło węgla i azotu dla bakterii A. rhizogenes zasiedlających przestrzenie międzykomórkowe w zainfekowanych tkankach roślin.
W praktyce laboratoryjnej proces transformacji przeprowadza się poprzez zanurzenie igły preparacyjnej w zawiesinie bakteryjnej, a następnie nakłucie tkanki roślinnej. Po upływie odpowiedniego czasu, w miejscu zranienia rośliny pojawia się charakterystyczna struktura licznych, drobnych korzeni. Każdą wiązkę korzeni włośnikowatych, powstałą w wyniku transformacji za pośrednictwem A. rhizogenes traktuje się jako niezależny materiał, co umożliwia pozyskanie i analizę znacznej liczby niezależnych od siebie linii transgenicznych [Hnatuszko – Konka; 2009].
Korzenie transformowane wykazują odmienne właściwości niż korzenie występujące naturalnie. Wśród nich wymienić należy przede wszystkim rozrost korzeni bocznych i ich plagiotropizm, zdolność do wzrostu w pożywce pozbawionej regulatorów wzrostu jak również brak przyrostu wtórnego czy geotropizmu. Istotną zaletą kultur korzeni transformowanych jest ich stabilność genetyczna. Wykazano, że kultury korzeni transformowanych mogą być prowadzone wiele lat, podczas gdy inne rodzaje kultur in vitro, jak np. kultura zawiesinowa czy kalus, wykazują skłonność do zmienności somaklonalnej, która może zaburzać produkcję metabolitów wtórnych. Ponadto korzenie włośnikowate charakteryzują się większym przyrostem biomasy w porównaniu do innych kultur roślinnych prowadzonych w warunkach in vitro [Bourgaud i inni, 2001].
Zdolność korzeni transformowanych do długotrwałej i stabilnej produkcji znaczących ilości metabolitów wtórnych (w tym także ważnych z punktu widzenia farmakologii) jest wykorzystywana w produkcji przemysłowej. Zazwyczaj wprowadzenie plazmidu bakteryjnego do rośliny nie wpływa na rodzaj wytwarzanych metabolitów. Są to te same produkty, które występują w korzeniach rosnących w gruncie, ale występują często w zwiększonym stężeniu. Metabolity wytwarzane przy zastosowaniu korzeni włośnikowatych osiągają znacznie większe ilości w porównaniu z innymi kulturami in vitro. Istotną cechą korzeni włośnikowatych jest to że są w stanie produkować wtórne metabolity jednocześnie ze wzrostem materiału roślinnego. Daje to możliwość ciągłego uzyskiwania wtórnych związków z aktywnie wzrastających korzeni włośnikowatych, w przeciwieństwie do zwykłych hodowli zawiesin komórkowych [Bourgaud i inni,2001]. Efekt ten może być dodatkowo zintensyfikowany poprzez manipulację warunkami kultury: składem pożywki, rodzajem używanego szczepu bakterii, selekcję klonów korzeni o najlepszych właściwościach. Przeprowadzenie procesu transformacji za pomocą A. rhizogenes nie jest łatwe. Na jej powodzenie składa się wiele czynników. Oprócz w/w elementów duże znaczenie może mieć genotyp bakterii A. rhizogenes oraz transformowanej rośliny, stopień integracji zachodzącej między rośliną a komórkami bakteryjnymi, gęstość inokulum oraz sposób wykonania inokulacji jak również metoda i skuteczność eliminacji A. rhizogenes z ko kultur
Jak podaje literatura najczęściej wykorzystywane są szczepy agropinowe 15834, A4, LBA9402 głównie ze względu na wysoki stopień wirulencji. W badaniach nad transformacją A. rhizogenes najczęściej wykorzystywano następujące szczepy: 1724, A4, 2659, TR105, 15834 oraz LBA 9402. Jednak wykazywały one różną zdolność do transformacji, tak na przykład 15834 okazał się wystarczająco skuteczny w przypadku Hyoscyamus arachnoideus czy Sesbania rostra ta [Hnatuszko-Konka i inni, 2009], zaś A4 zastosowano dla Valerianella lacustra, Tylophora indicta oraz Salvia officinalis [Wysokińska, Chmiel,2006].W procesie transformacji roślin z Asteraceae wykorzystano między innymi szczep TR105 do zakażenia Lactuca Floriana [Song i inni, 1995] czy szczep LBA 9405 do zakażenia Arnica Montana [Weremczuk-Jeżyna, Wysokinska, 2004] czy Lactuca virosa [Kisiel i inni, 1995].
Równie istotny jak wybór szczepu jest dobór odpowiedniego eksplantatu. Wybierane są zazwyczaj zdrowe, młode tkanki, tj. liście lub ich fragmenty, pędy, korzenie jak również siewki czy protoplasty. Badania prowadzone na Saussurea involucrata, zaliczanej do rodziny astrowatych wykazały, że transformacja prowadzona na korzeniach zachodzi z większą częstotliwością w porównaniu z infekcją blaszek liści [Chmiel, Wysokińska, 2004]. Wykorzystanie blaszki liściowej jako eksplantatu wykorzystano w badaniach nad roślinami zaliczanymi do astrowatych, tj. Lactula Floriana, Lactula virosa czy Arnica Montana. Liczne badania wykazały także, iż stymulujący wpływ na efektywność procesu transformacji ma wstępne traktowanie eksplantatu. Mogą to być czynniki fizyczne, (tj. mechaniczne zranienie tkanki za pomocą igły czy ultrasonifikacja) oraz czynniki chemiczne (np. celuloza, pektynaza, chlorek wapnia).
Kultury korzeni włośnikowatych hodowanych w świetle wykazują pewne różnice w biosyntezie metabolitów w porównaniu do tych uprawianych w ciemności. Prawdopodobnie spowodowane jest to obecnością chloroplastów, a co za tym idzie specyficznych enzymów w tkankach zielonych, otrzymywanych wyłącznie na świetle [Bourgaud i inni, 2001]. Potwierdzają to badania wykonane na A. Montana. Wynika z nich, że korzenie transformowane hodowane w ciemności wykazują lepszy wzrost w porównaniu z korzeniami hodowanymi w świetle. Ponadto wykazano, że laktony seskwiterpenowe wytwarzane są przede wszystkim przez korzenie rosnące na świetle, natomiast korzenie hodowane w ciemności charakteryzują się dużą zawartością kwasu chloragenowego [Weremczuk-Jeżyna, Wysokińska, 2004].
Nieodłącznym elementem przeprowadzenia skutecznego procesu transformacji jest dobór odpowiednich pożywek. Nie ma istotnych wytycznych dotyczących medium. Zakłada się, że powinna być ona typowa dla danej rośliny. W zależności od etapu prowadzenia kultury korzeni transformowanych można użyć różnego typu pożywek. Na etapie infekcji materiału roślinnego najczęściej stosowanym medium jest pożywka Murashige-Skoog (MS) bez regulatorów wzrostu. Taka pożywka była skuteczna między innymi w przypadku procesu zakażania arniki górskiej [Weremczuk-Jeżyna, Wysokinska, 2004]. Na etapie eliminacji bakterii i dalszego namnażania korzeni zazwyczaj stosuje się pożywkę modyfikowaną, tj. ½ MS [Kisiel i inni, 1995] czy ½ B5 zastosowaną podczas transformacji Salvia miltiorrhiza czy Salvia sclarea. Natomiast dla Salvia officinalis optymalną pożywką wydaje się podłoże Lloyda i McCowna.(WPM) [Wysokińska, Chmiel, 2006]. Przykład ten potwierdza fakt, że odpowiedni dobór pożywki, dostosowany do danej rośliny warunkuje efektywność procesu transformacji. Pożywkę ½ B5 zastosowano także w badaniach nad Artemisia Anna zaliczaną do rodziny astrowatych [Chatterjee i inni, 1997]. Nie bez znaczenia są także pożywki stosowane do namnożenia inokulum. Zaleca się dodatek związków fenolowych do pożywki stosowanej do wzrostu bakterii. Związki te odgrywają istotną rolę w chemotaksji i indukcji wirulencji A. rhizogenes. Podkreślić należy także fakt, że bakterie z tego rodzaju osiągają optimum wzrostu w temperaturze 260C i pH 5-9. Jest to istotna informacja przy ustalaniu warunków etapu szczepienia tkanek roślinnych [Wasilewska, Królicka; 2005].
Kolejnym ważnym etapem warunkującym wysokowydajną kulturę jest dobrze przeprowadzona selekcja transformantów. Przeprowadza się ją w taki sposób, że zakażone komórki roślinne umieszcza się na odpowiedniej pożywce wzbogaconej w antybiotyk bądź herbicyd. Najczęściej stosowanym antybiotykiem jest amplicylina, skuteczne działanie wykazuje także kanamycyna, karbenicylina [Orlikowska i inni, 2010]. W konsekwencji tego zabiegu na przeżycie i namnażanie mają szanse tylko te komórki, w których ekspresji ulega gen selekcyjny, zawierający gen obcy. Następnie, w procesie regeneracji z każdego pojedynczego klonu (pojedynczego korzenia) zostają odtworzone całe rośliny. Proces selekcji odpowiedniego transformatu podejmuje także inną kwestię. Biorąc pod uwagę, iż obcy gen może wbudować się w dowolnym miejscu genomu roślinnego, należy stwierdzić, jak wpływa to na ekspresję namnażania tkanki roślinnej oraz czy miejsce infekcji ma negatywny wpływ na funkcjonowanie rośliny. Dopiero prawidłowo wyselekcjonowane transformaty mogą zostać wykorzystywane do powiększania skali kultury, np. do bioreaktorów. [Jasiński i inni; 2006].
Literatura:
1. Bourgaud F., Gravot A., Milesi S., Gontier E.; 2001; Production of plant secondary metabolites: a historical perspective; Plant Science 161; 839–851.
2. Chatterjee C., Correll M.J., Weathers P.J., Wyslouzil B.E., Walcerz D.B.; 1997; Simplified acoustic window mist Bioreaktor; Biotechnology Techniques, Vol 11 No 3;. 155–158.
3. Chmiel A., Pawłowska B., Kochan E., Ledakowicz S.; 2001; Kultury korzeni transformowanych Paulownia tomentosa Steudt. W kolbach wstrząsanych i bioreaktorze rozpyłowym; Annales UMSC vol. IX ,Supl, Sectio EEE; 287-292.
4. Hnatuszko-Konka K., Luchniak P., Wiktorek-Smagur A., Gerszberg A., Kowalczyk T., Kononowicz A.K.; 2009; Transformacja roślin za pośrednictwem Agrobacterium rhizogenes. Postępy Biologii Komórki vol. 36, Supl. 25: 189-200.
5. Jasiński M., Banasik J., Frankowska M., Figlarowicz M.; 2006; Rośliny jako reaktory do produkcji biofarmaceutyków; Biotechnologia 3;53-66.
6. Kisiel W., Stojanowska A., Malarz J., Kohlmünzer S.;1995; Sesquiterpene lactones in Agrobacterium rhizogenes –transformed hairy roots culture of Lactuca virosa; Phytochemistry vol. 40; 1139-1140.
7. Orlikowska T., Sobiczewski P., Zawadzka M., Zenkteler E.; 2010; Kontrola i zwalczanie zakażeń i zanieczyszczeń bakteryjnych w kulturach roślinnych in vitro; Biotechnologia 2 (89); 57-71.
8. Song Q., Gomez-Barriose L., Hopper E.L., Hjortso M.A.,Fischer N. H.; 1995; Biosynthetic studies of derivatives in hairy roots cultures of Lactuca floridiana; Phytochemistry vol. 40; 1659-166.
9. Weremczuk-Jeżyna I., Wysokińska H.; 2004; Kultury korzeni transformowanych Arnica montana L.- izolacja metabolitów wtórnych; Biotechnologia 2(65); 54-60.
10. Wasilewska A., Królicka A.; 2005; Otrzymywanie i charakterystyka kultur korzeni włośnikowatych; Biotechnologia 4 (71); 173-188.
11. Wysokińska H. , Chmiel A. , 2006; Produkcja roślinnych metabolitów wtórnych w kulturach organów transformowanych; Biotechnologia 4 (75) 2006; 114-135.

