Autor: Monika Wójcik
Uniwersytet Przyrodniczy w Lublinie
Ksyloza jest białą substancją krystaliczną, dobrze rozpuszczalną w wodzie, wzór strukturalny D-ksylozy przedstawiono na rysunku poniżej. Temperatura topnienia waha się w granicach 148 – 153oC. Należy ona do cukrów pięciowęglowych, o wzorze sumarycznym C5H10O5.
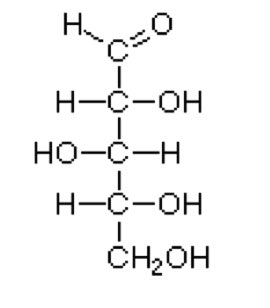
Rys. 1. Wzór strukturalny D – ksylozy [7].
Duże ilości ksylozy znajdują się w hemicelulozach głównie w postaci polimeru ksylanu. Znaleziono ją między innymi w jagodach, szpinaku, brokułach i gruszkach. Ksyloza znalazła zastosowanie między innymi jako:
polepszacz smaku i zapachu żywności (posiada status GRAS),
suplement diety,
składnik testów diagnostycznych,
substancja grzybobójcza i antybakteryjna w zwalczaniu chorób jamy ustnej oraz nowotworów jelita [6].
Transport ksylozy
Powstałe podczas hydrolizy hemiceluloz monosacharydy, disacharydy, oligosacharydy mogą być transportowane do wnętrza komórek mikroorganizmów. Systemy transportu poszczególnych cukrów zależne są nie tylko od rodzaju drobnoustroju wziętego do hodowli, ale również od warunków samej hodowli, w tym od składu podłoża, stężenia cukrów, dostępności tlenu, temperatury i pH.
Wychwyt cukru może odbywać na drodze ułatwionej dyfuzji, która nie wymaga energii metabolicznej, a jedynie gradientu stężeń oraz poprzez transport aktywny, wymagający energii, występującej w postaci ATP lub fosfoenolopirogronianu (PEP) [3].
Drożdże Saccharomyces cerevisiae nie posiadają transporterów specyficznych dla ksylozy, a jej pobieranie odbywa się za pomocą znajdujących się w ich komórkach nośników glukozy, kodowanych przez rodzinę genów HXT. Transportery te odznaczają się znacznie mniejszym powinowactwem do ksylozy niż do glukozy. W przypadku gdy w podłożu znajdują się oba te cukry, transport ksylozy jest konkurencyjnie hamowany przez glukozę. Dopiero po wyczerpaniu heksozy następuje asymilacja pentozy.
W przypadku wzrostu na ksylozie jako jedynym źródle węgla geny takie jak Hxt5 i Hxt7 są uważane za szczególnie ważne w transporcie ksylozy. Pomimo prób zwiększenia efektywności fermentacji ksylozy poprzez nadekspresję takich genów jak Hxt7 i Gal2 kodujących transportery ksylozy, nie zaobserwowano żadnych istotnych zmian na poziomie szybkości fermentacji tej pentozy. Dalsze analizy obejmujące chociażby identyfikację białek odpowiedzialnych za poprawę transportu ksylozy oraz jej fermentacji koncentrują się na badaniu nadekspresji innych genów związanych z transportem tego cukru w tym Agt1 (kodujący indukowany transporter o wysokim powinowactwie do maltozy) oraz Snf3 (kodujący sensor błony komórkowej regulujący transport glukozy) [4].
Metabolizm ksylozy
Etanol może być wytwarzany nie tylko z powszechnie dostępnej i używanej glukozy, ale również z zawartej w hemicelulozach ksylozy. Proces ten prowadzą niektóre gatunki bakterii i drożdży. W przypadku bakterii pierwsza reakcja katalizowana przez ksylozoizomerazę prowadzi do przekształcenia ksylozy bezpośrednio w ksylulozę. Drożdże natomiast nie posiadają tego enzymu i najpierw redukują ksylozę do ksylitolu z udziałem enzymu ksyloreduktazy, a w następnej reakcji katalizowanej przez dehydrogenazę ksylitolu, ksylitol jest przekształcany do ksylulozy [1]. U większości drożdży zdolnych do metabolizowania ksylozy, enzym reduktaza ksylozy zależy od NADPH, a dehydrogenaza ksylitolu zależy od NAD. Brak enzymu transhydrogenazy odpowiedzialnego za przekształcanie NADH (produkt pierwszej reakcji) do NADPH (substrat pierwszej reakcji) prowadzi do niezbilansowania kofaktorów, a w konsekwencji część metabolizowanej ksylozy przekształca się w ksylitol, który gromadzi się w podłożu [5].
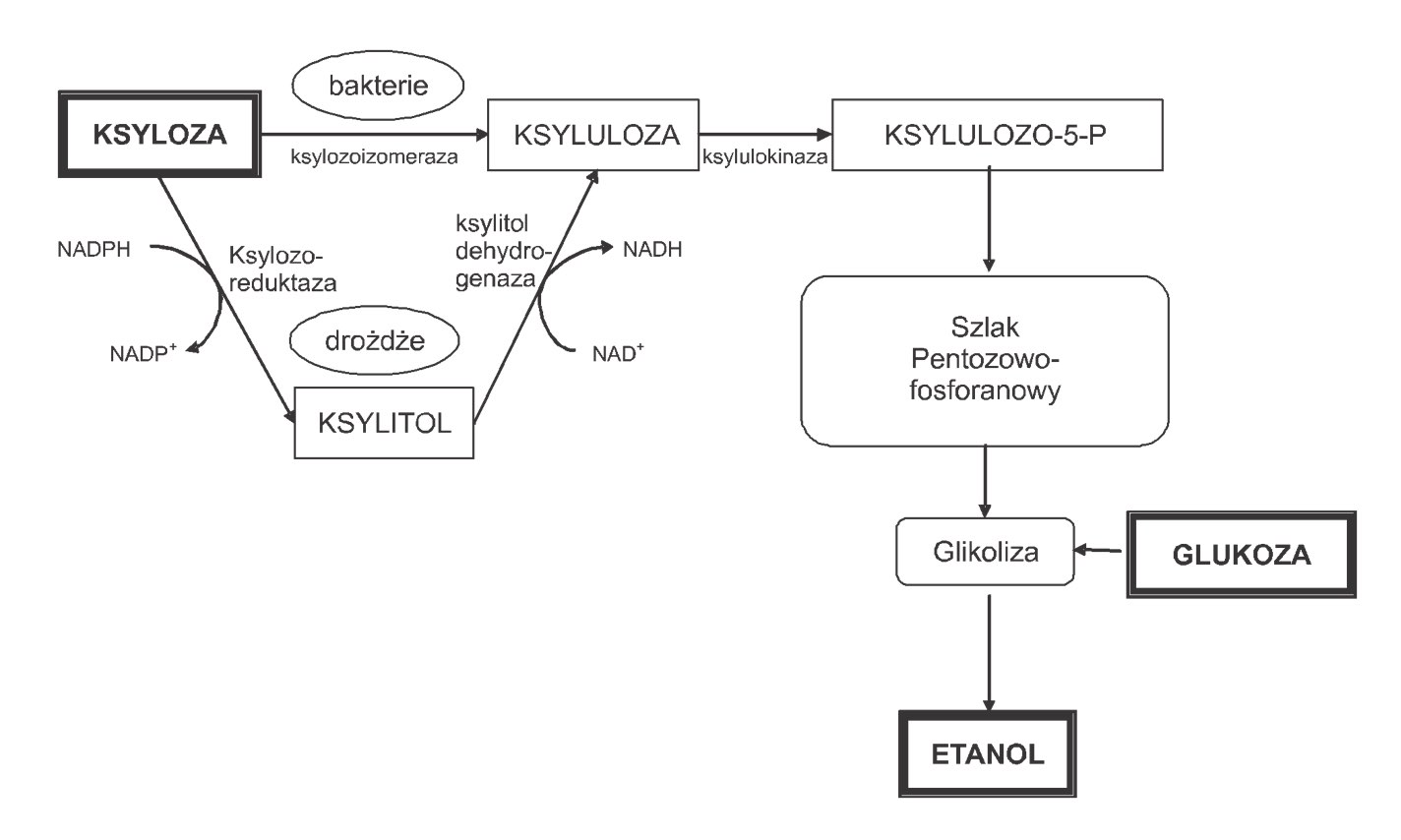
Rys. 2. Schemat przekształcania ksylozy do etanolu [5].
Kolejne etapy metabolizmu ksylozy zarówno u bakterii jak i drożdży zachodzą tą samą drogą. Otrzymana ksyluloza ulega fosforylacji z udziałem enzymu ksylulokinazy, a produktem przemiany jest ksylulozo – 5 – fosforan. Związek ten wchodzi w szlak pentozowo-fosforanowy i zostaje przekształcony w intermedianty glikolizy – aldehyd 3-fosfoglicerynowy, fruktozo-6-fosforan, które następnie mogą być przekształcane do etanolu [2].
Literatura:
1. Bettiga M., Hahn-Hägerdal B., Gorwa-Grauslund M.F.: Comparing the xylose reductase/xylitol dehydrogenase and xylose isomerase pathways in arabinose and xylose fermenting Saccharomyces cerevisiae strains. Biotechnology for biofuels, (2008), 1(1).
2. Chandel A. K., Chandrasekhar G., Radhika K., Ravinder R., Ravinder P.: Bioconversion of pentose sugars into ethanol: A review., Biotechnol. and Molec. Biol. Review, (2011), 6(1): 8-20.
3. Gírio F.M., Fonseca C., Carvalheiro F., Duarte L.C, Marques S, Bogel-Łukasik R.: Hemicelluloses for fuel ethanol: A review., Bioresour. Technol., (2010), 13: 4775-4800.
4. Matsushika A., Inoue H., Kodaki T., Sawayama S.: Ethanol production from xylose in engineered Saccharomyces cerevisiae strains: current state and perspectives., Appl. Microbiol. Biotechnol., (2009), 84: 37-53.
5. Sybirny W., Puchalski C., Sybirny A.: Metaboliczna inżynieria drobnoustrojów do konstruowania wydajnych producentów bioetanolu z lignocelulozy., Biotechnologia., (2007), 4(79): 38-54.
6. www.glyconutritionforlife.org
7. www.scientificpsychic.com

