PRZEDRUK, oryginał dostępny pod adresem www
Fragment skryptu: Spektroskopia Masowa
Autor skryptu: dr Barbara Drożdż
Uniwersytet Jagielloński (www)
Wydział Farmaceutyczny Collegium Medicum (www)
Katedra Chemii Organicznej (www)
Kierownik: Prof. UJ, dr hab. Marek Cegła
Adres:
ul. Medyczna 9
30-688 Kraków
Kontakt: tel. 012 620 55 00
Główne drogi rozpadu
We wszystkich rodzajach związków organicznych pojawiają się pewne, omówione poniżej, wspólne typy fragmentacji.
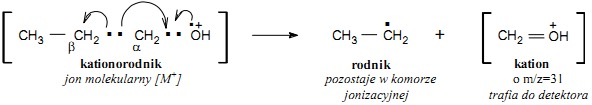
Rozszczepienie alfa
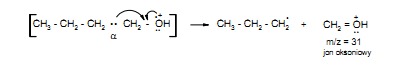
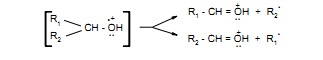
Ten rodzaj rozszczepienia zachodzi pomiędzy atomami alfa i beta względem heteroatomu. Ulegają mu takie związki jak alkohole i tiole, etery i tioetery, aminy oraz związki zawierające grupy karbonylowe – aldehydy, ketony, kwasy, estry, amidy. Rozszczepienie alfa zachodzi dzięki stabilizacji rezonansowej powstającego kationu, jak to pokazano na przykładzie propan-1-olu.
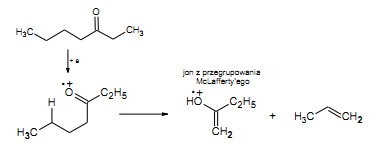
Przegrupowanie McLafferty’ego
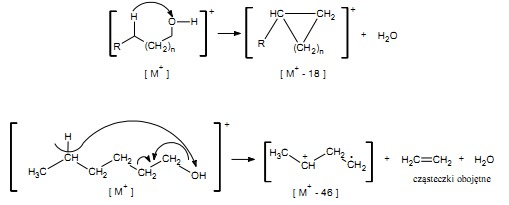
Przegrupowanie McLafferty’ego może zachodzić tylko dla związków posiadających atomy wodoru przy atomie węgla w położeniu delta w stosunku do atomu będącego kationorodnikiem.
Mechanizm tej reakcji polega na powstawaniu cyklicznego, sześcioczłonowego stanu przejściowego, w którym następuje przeniesienie atomu wodoru do kationorodnika, a następnie rozpad powstałej cząsteczki na kation i nienasyconą cząsteczkę obojętną. Przegrupowaniu McLafferty’ego ulegają między innymi alkeny, węglowodory aromatyczne z podstawnikami alifatycznymi, nitryle, aldehydy, ketony oraz kwasy karboksylowe i ich pochodne. Mechanizm tego typu przegrupowania pokazano na przykładzie pentanalu.
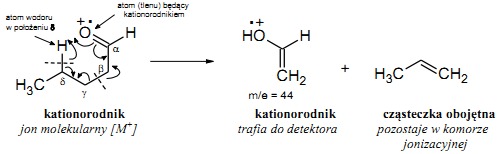
Przegrupowanie McLafferty’ego w cząsteczce pentanalu
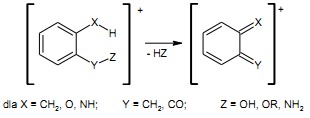
Efekt orto
Pewne dipodstawione związki aromatyczne z podstawnikami w położeniu 1 i 2 łatwo eliminują obojętne cząsteczki przechodząc przez sześcioczłonowy stan przejściowy. Piki powstających w tych reakcjach jonów mają z reguły duże intensywności.
Charakterystyka dróg rozpadu głównych grup związków organicznych
Węglowodory łańcuchowe Najbardziej charakterystycznym elementem widm alkanów są grupy pików pochodzące od jonów powstałych w wyniku fragmentacji łańcucha, oddalonych od siebie o 14 jednostek masy.
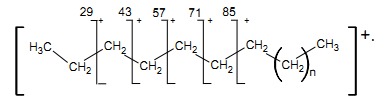
Alkany rzadko dają możliwy do zidentyfikowania pik jonu molekularnego, gdyż jego intensywność maleje w miarę wzrostu długości łańcucha węglowodorowego i jego stopnia rozgałęzienia. Na rys.7 przedstawiającym widmo ikozanu ( C20H42) wyraźnie widać grupy pików, w których najintensywniejszy pochodzi od jonu CnH2n+1+, a towarzyszą mu piki CnH2n+ i CnH2n-1+. W widmie alkanów o łańcuchach prostych najwyższe intensywności posiadają piki pochodzące od trzy i czterowęglowych fragmentów ( m/z = 43 i 57 ), natomiast nie zauważa się pików pochodzących od jonów M+ – 15.
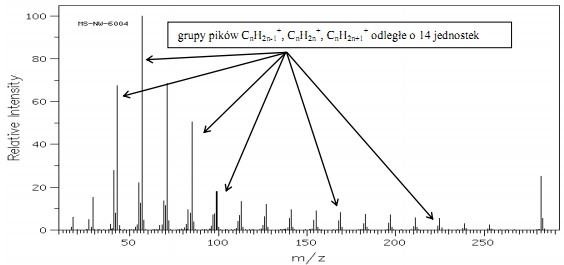
Rys.7 Widmo MS ikozanu C20H42.
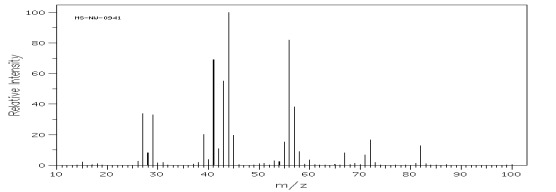
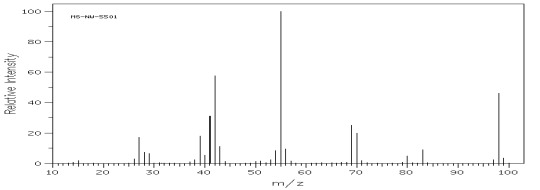
Węglowodory rozgałęzione ulegają przede wszystkim rozpadom przy trzecio i czwartorzędowym atomie węgla w wyniku czego odpowiadające im piki mają największą intensywność, co może stanowić wartość diagnostyczną w analizie ich widma (rys.8 i 9).
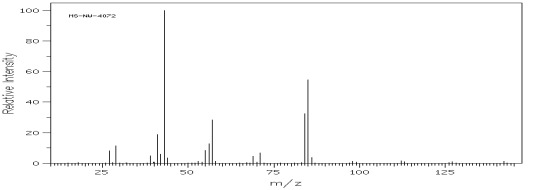
Rys.8 Widmo MS 5-metylononanu (C10H22).
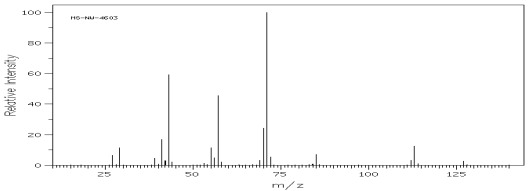
Rys.9 Widmo MS 3,3-dimetylooktanu (C10H22).
Węglowodory nienasycone
Węglowodory zawierające wiązania nienasycone dają często wyraźne piki molekularne. Ładunek dodatni powstających jonów fragmentacyjnych jest na ogół umiejscowiony we fragmencie zawierającym wiązanie nienasycone. W widmie pojawiają się, podobnie jak w alkanach, grupy pików odległe o 14 daltonów, wśród których najwyższy odpowiada jonowi CnH2n-1+ (a nie CnH2n+1) co wyraźnie odróżnia je od widm alkanów (rys.10).
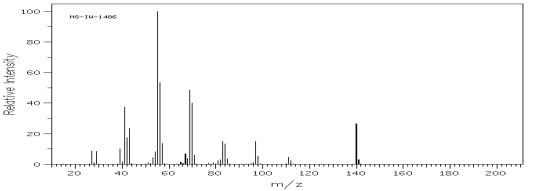
Rys.10 Widmo MS dek-5-enu (C10H20) – (pik 41 jest wyższy od 43).
Cykloheksen i jego pochodne ulegają charakterystycznej fragmentacji określanej jako reakcja retrodienowa – reakcja przeciwna do reakcji Dielsa-Aldera, w wyniku której powstaje dodatnio naładowana cząsteczka dienu i obojętna cząsteczka alkenu (rys.11).
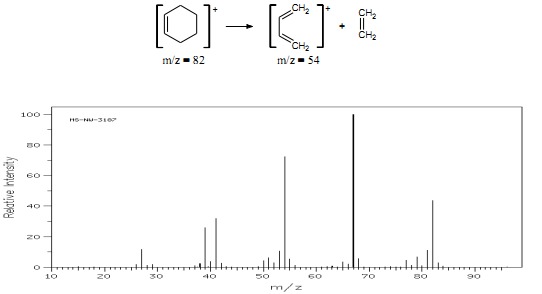
Rys.11 Widmo MS cykloheksenu.
Węglowodory aromatyczne
Jony molekularne węglowodorów aromatycznych charakteryzują się dużą trwałością, dzięki czemu odpowiadające im piki posiadają dużą intensywność i często są pikami głównymi. Niewielką intensywność, ale istotne znaczenie, ma obecność piku pochodzącego od jonu powstałego przez odszczepienie acetylenu od jonu molekularnego, w przypadku benzenu występującego przy m/z = 52 ( C4H4+ ).
W widmach pochodnych benzenu pojawiają się zazwyczaj charakterystyczne sekwencje pików pochodzące od poniższych jonów:
– ( C3H3+ ) m/z = 39,
– ( C4H2+ ) m/z = 50, ( C4H3+ ) m/z = 51, ( C4H4+ ) m/z = 52
– ( C5H3+ ) m/z = 63, ( C5H4+ ) m/z = 64, ( C5H5+ ) m/z = 65
– ( C6H3+ ) m/z = 75, ( C6H4+ ) m/z = 76, ( C6H5+ ) m/z = 77, ( C6H6+ ) m/z = 78
– alkilowe pochodne dają ( C6H7+ ) m/z = 79
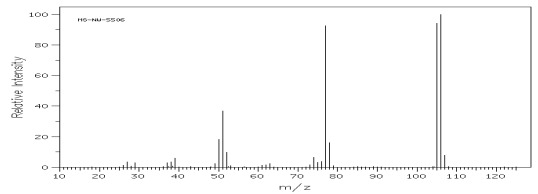
Dla alkilowych pochodnych benzenu najbardziej charakterystyczny pik pochodzi od jonu o m/z = 91, będącego rezultatem rozszczepienia, w wyniku, którego powstaje bardzo trwały jon tropyliowy. Fragmentacja jonu tropyliowego zachodzi przez odszczepienie kolejnych cząsteczek acetylenu (rys.12).
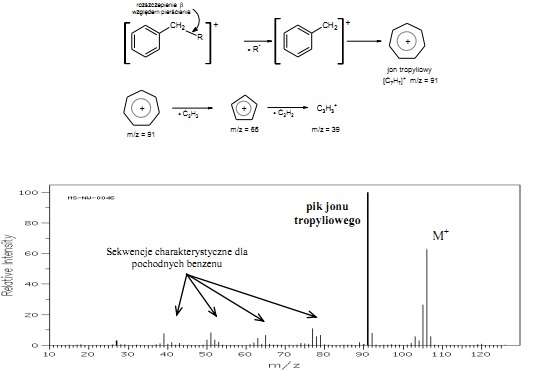
Rys.12 Widmo MS o-ksylenu z charakterystycznym jonem tropyliowym m/z = 91 i sekwencjami pików o m/z = 39, 50 – 53, 63, 65, 77, 78, 79.
Węglowodory aromatyczne o łańcuchach bocznych, zawierających przynajmniej trzy atomy węgla, posiadają piki pochodzące z przegrupowania McLafferty’ego (rys.13).
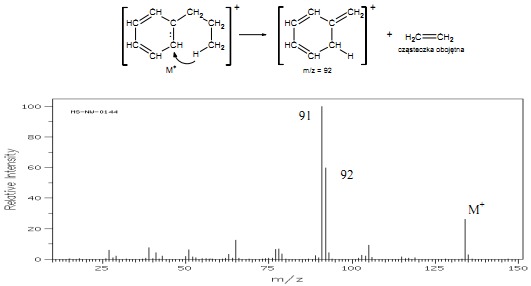
Rys.13 Widmo MS butylobenzenu z charakterystycznym jonem tropyliowym m/z = 91 i jonem m/z = 92 pochodzącym z przegrupowania McLafferty’ego.
Alkohole
W widmach alkoholi alifatycznych na ogół nie pojawia się pik jonu molekularnego. Wyjątek stanowią alkohole o krótkich łańcuchach (do czterech atomów węgla). Najbardziej charakterystyczny rozpad alkoholi jest rezultatem rozszczepienia alfa względem grupy hydroksylowej w wyniku, którego powstaje jon oksoniowy, będący często pikiem głównym. Dla alkoholi pierwszorzędowych jest to pik o m/z = 31 ( CH2= OH+ ).
W alkoholach I rzędowych pojawiają się również piki będące wynikiem rozpadu dalszych wiązań względem grupy hydroksylowej, o wartościach m/z = 45, 59 itd. Pik m/z = 31 występujący w widmach alkoholi II i III rzędowych ma mniejszą intensywność niż w przypadku alkoholi I rzędowych. Jest wynikiem rozpadu alfa i następującego po nim przegrupowania. Alkohole II i III rzędowe w wyniku rozszczepienia alfa tracą największy podstawnik tworząc jony o wartościach m/z = 45, 59, 73, 87 itd. Dla alkoholi zawierających w rozgałęzieniu grupę metylową pojawia się pik M+ – 33 o dużej intensywności, powstający po utracie jednocześnie cząsteczki wody i grupy metylowej.
Dużą rolę diagnostyczną w identyfikacji alkoholi odgrywają piki jonów powstałych przez odszczepienie cząsteczki wody ( M+ – 18 ), a także jony powstałe przez jednoczesne odszczepienie cząsteczki wody i alkenu, wśród których największą intensywność ma pik M+ – 46 odpowiadający odszczepieniu wody i etenu.
We wszystkich alkoholach łańcuchowych pojawiają się piki związane z fragmentacją łańcucha węglowego, których sekwencja odpowiada widmom alkenów omówionym w rozdziale dotyczącym węglowodorów. Dla alkoholi długołańcuchowych piki związane z fragmentacją łańcucha węglowego stanowią większość pików widma.
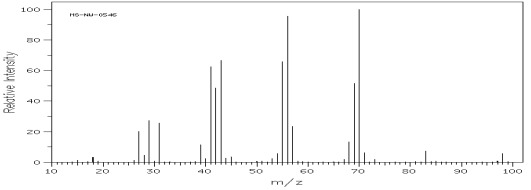
Rys.14 Widmo MS heptan-1-olu – alkohol I rzędowy.
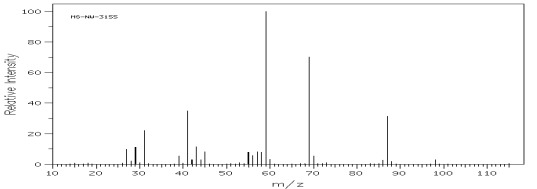
Rys.15 Widmo MS heptan-3-olu – alkohol II rzędowy.
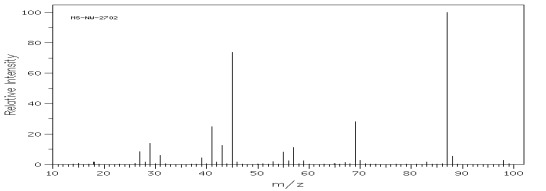
Rys.16 Widmo MS 3-etylopentan-3-olu – alkohol III rzędowy.
Fragmentacja cykloheksanolu, pokazana na schemacie poniżej, daje charakterystyczny jon o m/z = 57 (rys.17).
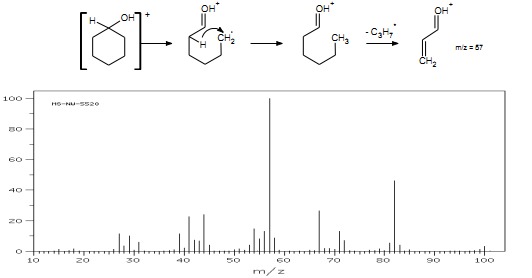
Rys.17 Widmo MS cykloheksanolu.
Alkohol benzylowy, w przeciwieństwie do alkoholi alifatycznych, charakteryzuje wyraźny pik jonu molekularnego i towarzyszący mu pik (M+ – 17), odpowiadający odszczepieniu grupy hydroksylowej i utworzeniu jonu tropyliowego.
Fenole
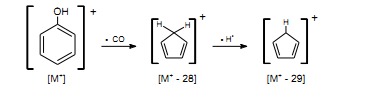
Fenole zawierają pierścień aromatyczny, w związku z czym wykazują wyraźny pik jonu molekularnego oraz jonu (M+ – 1), powstałego przez odszczepienie rodnika wodorowego. Nie obserwuje się na ogół pików jonów powstałych przez odszczepienie grupy OH. Rozpad fenoli przebiega również na drodze przegrupowań połączonych z eliminacją atomu węgla z pierścienia w postaci grupy CO oraz CO i rodnika wodorowego, co skutkuje powstaniem odpowiednio pików (M+ – 28) i (M+ – 29).
W pochodnych fenoli podstawionych w pozycji 2 względem grupy hydroksylowej podstawnikami, jak np. CH2OH, CH2OR, CH2NH2, mogą pojawiać się produkty przegrupowania związanego z efektem orto.
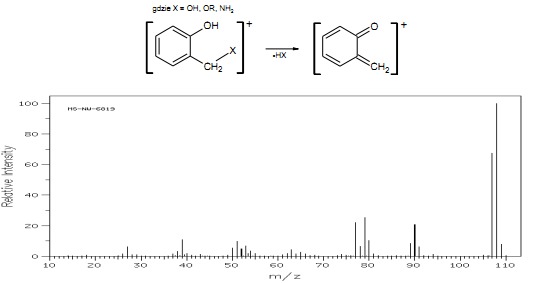
Rys.19 Widmo MS o-krezolu.
Aldehydy i ketony
Piki jonów molekularnych aldehydów alifatycznych są słabe, natomiast aldehydów i ketonów aromatycznych intensywne.
Identyfikując jon molekularny należy pamiętać, że masy cząsteczkowe aldehydów i ketonów mają takie same wartości jak alkany zawierające o jeden atom węgla więcej, np. butan (C4H10), propanal (C2H5CHO) i propanon (CH3COCH3) mają masę 58u, dlatego obecność jonu masowego o określonej wartości m/z nie ma takiej wartości diagnostycznej jak w innych klasach związków.
Charakterystycznym typem rozpadu dla aldehydów i ketonów jest rozszczepienie alfa względem grupy C=O, które w różnych związkach karbonylowych prowadzi do przedstawionych poniżej produktów : – w aldehydach alifatycznych (R-CHO) dochodzi do rozpadu alfa względem grupy karbonylowej i powstania jonu [HCO]+ o m/z=29 oraz odpowiedniego rodnika alkilowego (rys.20):
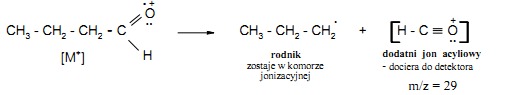
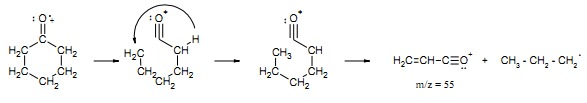
– rozszczepienie alfa cykloheksanonu (widmo rys.21) prowadzi do rozerwania pierścienia zachodzącego wg schematu:
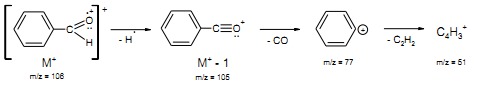
– w aldehydach aromatycznych (Ar-CHO) rozerwaniu ulega wiązanie C-H w grupie CHO w wyniku czego powstaje kation acyliowy [Ar-CO]+ i rodnik wodorowy. Dlatego cechą charakterystyczną widm masowych aldehydów aromatycznych jest obecność intensywnego piku [M-H]+, pik ten często pozwala na odróżnienie aldehydów od ketonów (rys.22).
– w ketonach alifatycznych dochodzi w pierwszej kolejności do oderwania większego podstawnika (rys.23)

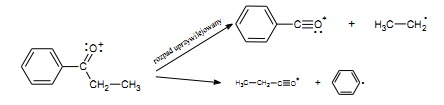
– w ketonach alifatyczno- aromatycznych kation tworzy się głównie przez oderwanie rodnika alkilowego (rys.24)
Aldehydy i ketony alifatyczne o odpowiedniej ilości atomów węgla ulegają reakcji przegrupowania McLafferty’ego, a powstające w tym procesie jony stanowią najczęściej jony główne (rys.20).
Aldehydy o prostych łańcuchach dają piki (rys.20): – M+-18 powstały w wyniku utraty cząsteczki wody – M+-28 powstały w wyniku utraty cząsteczki etylenu – M+-43 powstały w wyniku utraty rodnika CH2 = CH – O – M+-44 powstały w wyniku utraty cząsteczki CH2 = CH – OH
Rys.20 Widmo MS heksanalu.
Rys.21 Widmo MS cykloheksanonu.
Rys.22 Widmo MS benzaldehydu.
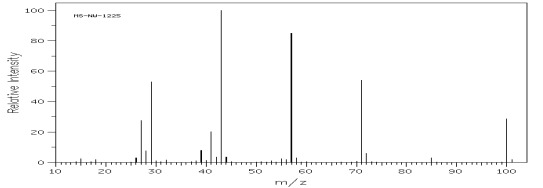
Rys.23 Widmo MS heksan-3-onu mcz=100.
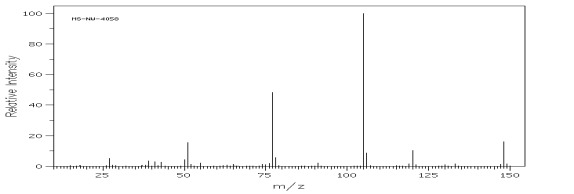
Rys.24 Widmo MS 1-fenylobutan-1-onu.
Kwasy karboksylowe
Alifatyczne kwasy krótkołańcuchowe i kwasy aromatyczne wykazują wyraźne piki jonów odpowiadające odszczepieniu grupy OH (M+ – 17) i COOH (M+ – 45) będące wynikiem rozszczepienia alfa względem grupy karbonylowej.
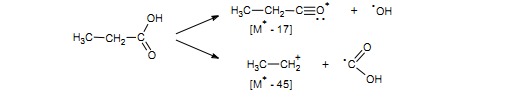
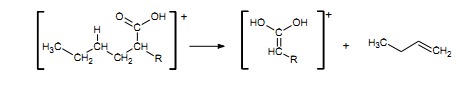
W widmach kwasów o długości łańcucha równej lub większej niż cztery atomy węgla najintensywniejszy pik pojawia się dla jonów będących efektem przegrupowania McLafferty’ego, w wyniku którego powstaje pik o m/z= 60, 74, 88 itd.
Kwasy aromatyczne z podstawnikami w położeniu 2 zawierającymi wodór mogą dawać jony będące wynikiem przegrupowania związanego z efektem orto.
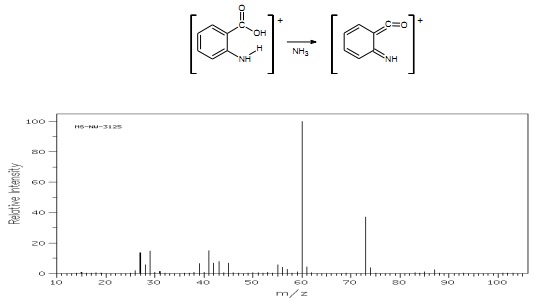
Rys.25 Widmo MS kwasu pentanowego.
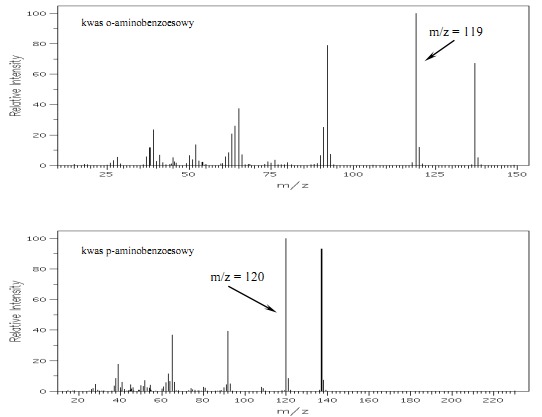
Rys.26 Widmo MS kwasu o-aminobenzoesowego i p-aminobenzoesowego.
Aminy
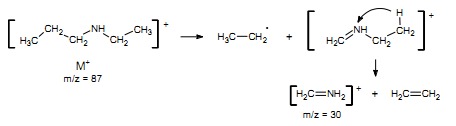
Wszystkie aminy muszą spełniać opisaną wcześniej regułę azotu. W aminach alifatycznych pik jonu molekularnego jest słaby, a dla amin o długich lub rozgałęzionych łańcuchach jest niewidoczny. W rozpadach najczęściej pojawiają się fragmenty będące wynikiem rozszczepienia alfa względem atomu azotu. Ważnym wskaźnikiem obecności aminy alifatycznej jest obecność jonu o m/z = 30 pochodzącego od fragmentu [CH2=NH2]+ dającego na ogół pik główny.
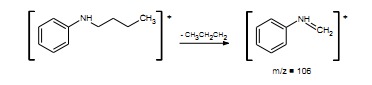
W aminach aromatycznych piki molekularne są mocne i towarzyszą im piki (M+-1). Jon molekularny aniliny najczęściej traci obojętną cząsteczkę HCN dając silny pik o m/z = 66, który z kolei traci rodnik wodorowy dając jon o m/z = 65. Wpływ innych podstawników może powodować utratę rodnika NH2. Aminy aromatyczne z podstawnikami w pozycji 2 dają piki z przegrupowania związanego z efektem orto. Drugorzędowe aminy aryloalifatyczne ulegają rozpadom z utworzeniem jonu o m/z = 106 powstającego wg poniższego schematu:
Związki nitrowe
Alifatyczne związki nitrowe w procesie fragmentacji odszczepiają rodnik NO2, w wyniku czego ładunek powstaje na części alkilowej i widmo przypomina widmo MS alkanu. Nitrozwiązki aromatyczne dają silny pik jonu molekularnego, a ich fragmentacja zachodzi na ogół wg podanego poniżej schematu.
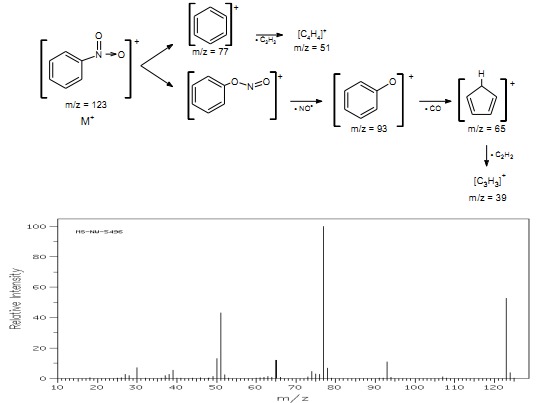
Rys.27 Widmo MS nitrobenzenu.
Aromatyczne związki nitrowe z grupą metylową lub aminową w położeniu orto dają jony z przegrupowania orto
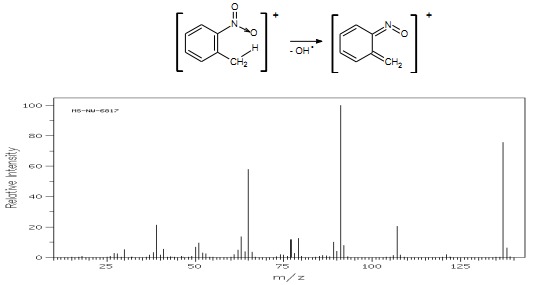
Rys.28 Widmo MS o-nitrotoluenu.

