Cytometria przepływowa (ang. flow cytometry – FCM) jest techniką analityczną pozwalającą na szybki pomiar rozproszonego światła lub sygnałów fluorescencji emitowanych przez odpowiednio naświetlone komórki. Pozwala ona ocenić zarówno jakościowo, jak i ilościowo właściwości fizyczne i biologiczne komórek oraz niektórych ich komponentów: jąder, kwasów nukleinowych, mitochondriów i chloroplastów. Cytometria przepływowa została odkryta jako ulepszenie mikroskopu fluorescencyjnego i cechuje się wysoką wydajnością, która pozwala na analizowanie różnych parametrów u dużej liczby komórek, w stosunkowo krótkim czasie. Uzyskane wyniki opracowuje się statystycznie.
Historia
Początki cytometrii przepływowej datuje się na rok 1934, w którym to na łamach czasopisma Scence ukazał się artykuł opisujący możliwość wykorzystania czujnika fotoelektrycznego do zliczania komórek przepływających przez kapilarę. Autor tego pomysłu – Andrew Moldavan, nigdy nie wprowadził w życie swojego nowatorskiego projektu. Mimo to, pierwsze urządzenia tego typu zaczęto konstruować już w latach 40-tych. Za ich pomocą analizowano zawieszone w powietrzu komórki bakteryjne.
Projekty te zainspirowały armię amerykańską, która w okresie II Wojny Światowej postanowiła wykorzystać nową technikę do wykrywania broni biologicznej. Próbki powietrza analizowano w komorze przepływu w ciemnym polu i oświetlano za pomocą reflektora samochodu marki Ford. W tamtych czasach była to najmocniejsza spośród znanych lamp, a jej zastosowanie pozwalało na detekcję cząstek o średnicy 0,6 μm z 60% dokładnością. Wyniki tych badań odtajniono dopiero w 1947 roku.
Do 1970 roku istniały jedynie dwie firmy na rynku cytometrycznym: Bio/Physis Systems (Ameryka) produkująca Cytograf i Cytofluorograf oraz Phywe AG (Niemcy) dystrybuująca Impulscytophotometr (IPC).
Na początku lat 80-tych, dzięki równoczesnemu zastosowaniu dwóch typów fluorescencyjnie wyznakowanych przeciwciał, możliwe stało się jednoczesne analizowanie kilku rodzajów białek. Idąc tym tropem, trzy duże firmy: Becton-Dickinson, Coulter i Ortho wprowadziły do swojej oferty laserowe cytometry przepływowe umożliwiające rozdział badanych cząsteczek. Stopniowo wprowadzano również inne ulepszenia dotyczące sprawności sortownia i przetwarzania danych.
Obecnie na rynku dominują trzy wielkie firmy cytometryczne: BD Biosciences (www.bdbiosciences.com), Beckman Coulter (www.beckmancoulter.com ) oraz DakoCytomation (www.dako.com).
Cytometr przepływowy
Wyróżnia się dwa podstawowe typy cytometrów przepływowych:
• analizatory – wykorzystywane w laboratoriach badawczych do oceny ekspresji antygenów powierzchniowych i wewnątrzkomórkowych (np. cytokin, hormonów), aktywności enzymów (np. kinaz, kaspaz) lub też ekspresji genów i transkrypcji mRNA dla różnych produktów komórkowych (technika FISH);
• sortery komórkowe – mające zdolność nie tylko do zbierania i analizowania danych o przepływających komórkach, ale również do ich sortowania, tzn. odchylania płynących cząstek zgodnie z różnicami ich potencjału elektrycznego. Umożliwia to dodatkową ocenę niektórych parametrów czynnościowych. Stopień czystości izolacji komórek spełniających określone kryteria wynosi ponad 99%. Dzięki swej dużej wydajności, sortery wykorzystywane są do izolacji bardzo rzadkich komórek, takich jak zawieszone w krwi komórki nowotworowe, erytrocyty płodowe, czy też komórki zmodyfikowane genetycznie. Urządzenia te znalazły zastosowanie również przy przeszczepach oraz zapłodnieniach pozaustrojowych.
Istnieją także cytometry zaprojektowane do ściśle określonych zadań, np. do wykrywania, charakterystyki i zliczania mikroorganizmów zawieszonych w wodzie lub też komórek somatycznych i bakteryjnych znajdujących się w mleku.
Budowa cytometru przepływowego
Typowy cytometr przepływowy składa się z:
• układu hydraulicznego, wytwarzającego strumień cieczy otaczającej zawiesinę komórkową. Z jego pomocą badane cząsteczki przechodzą przez punkt pomiarowy z odpowiednią prędkością;
• źródła światła, które przechodząc przez badane cząstki wytwarza sygnał rozproszenia i fluorescencji. Funkcję tą może spełniać laser (ten rodzaj cytometru pobudza fluorochromy związane z komórkami i dzięki temu znalazł szerokie zastosowanie w immunologii i hematologii) lub lampa łukowa (stosowana głównie w mikrobiologii ze względu na swoją wszechstronność i lepszą rozdzielczość rozproszenia). Wybór oświetlenia powinien być uzależniony od rodzaju stosowanych barwników fluorescencyjnych;
• układu optycznego, kształtującego i ogniskującego wiązkę laserową na badanej komórce. W jego skład wchodzi również optyka zbierająca, której zadaniem jest odfiltrowywanie poszczególnych długości fali oraz ogniskowanie promieni świetlnych na fotokatodzie detektorów;
• układu elektrycznego przetwarzającego sygnały świetlne na impulsy elektryczne (analogowe);
• systemu analizy danych, czyli odpowiedniego oprogramowania pozwalającego na statystyczne opracowanie uzyskanych wyników.
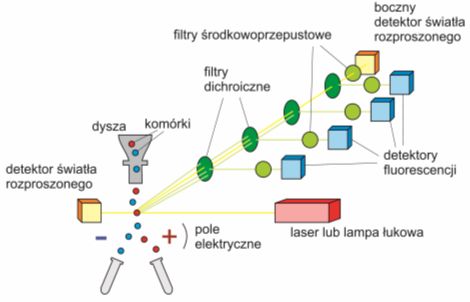
Rys. 1. Schemat budowy cytometru przepływowego. Filtry dichroiczne odbijają fale krótkie i pozwalają na transmisję fal długich; filtry środkowoprzepustowe przepuszczają jedynie światło z bardzo wąskiego zakresu długości fali. Użycie właściwych filtrów pozwala stwierdzić obecność określonych znaczników w badanej próbce.
Zasada działania cytometru przepływowego
Znakowane komórki formowane są w cienki strumień, który z odpowiednią prędkością przesuwa się w stronę strefy pomiaru. Tam, każda pojedyncza cząstka naświetlana jest zogniskowaną wiązką laserową. Światło ulega rozproszeniu i jednocześnie wzbudza przyłączone do komórek fluorochromy. Powstałe sygnały mierzone są za pomocą odpowiednich detektorów, przemieniane na impulsy elektryczne, wzmacniane i przesyłane do komputera celem dalszej obróbki, przechowywania i analizy.
Podstawowym pomiarem jest rejestrowanie światła rozproszonego. Wyniki jego analizy dostarczają informacji o wielkości, kształcie badanej komórki oraz o jej wewnętrznych ziarnistościach. Rodzaj uzyskanych danych zależy od typu użytych detektorów. Jedne z nich – FSC lub inaczej FS, rejestrują rozproszenie zgodnie z kierunkiem wiązki laserowej. Rośnie ono wraz z powiększaniem się rozmiaru cząsteczki. Detektory SSC lub SS rejestrują rozproszenie pod kątem 90° zależne od wielkości i kształtu cząsteczki oraz jej współczynników załamania i odbicia światła.
Aby uzyskać dodatkowe informacje (np. odróżnić komórki pojedyncze od zlepionych – tzw. dyskryminacja dubletów) konieczne jest zastosowanie odpowiednich znaczników fluorescencyjnych. Istnieje kilka rodzajów fluorochromów, różniących się między sobą sposobem działania. Niektóre z nich emitują sygnał jedynie po przyłączeniu się do specyficznych składników komórkowych: białek (izotiocyjanian fluoresceiny, ang. fluorescein isothiocyanate – FITC), kwasów nukleinowych (jodek propidyny, ang. propidium iodiode – PI) i tłuszczy (Czerwień Nilu, ang. Nile Red). Inną grupą są tzw. fluorogeniczne substraty, których aktywność zależy od obecności odpowiednich enzymów. Wyróżnia się także znaczniki związane z fizjologicznymi parametrami komórki (pH< potencjał błonowy, itp.).
Fluorochromy mogą być przyłączane do przeciwciał lub sąd nukleotydowych i w ten sposób służyć do bezpośredniego wykrywania antygenów oraz sekwencji DNA i RNA.
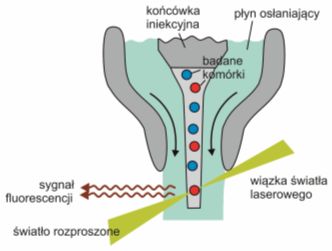
Rys. 2. Zawieszone w cieczy komórki przechodzą przez wiązkę światła i emitują charakterystyczne dla siebie sygnały.
Standaryzacja wyników
Dzięki stałemu układowi optycznemu i cyfrowym układom elektronicznym, cytometr umożliwia jednoczesną, wielobarwną analizę maksymalnie sześciu znaczników fluorescencyjnych i dwóch parametrów rozpraszania.
Choć stwarza to ogromne możliwości analityczne, to równocześnie niesie za sobą ryzyko błędu oraz rodzi trudności przy porównywaniu uzyskiwanych danych.
Z tego powodu należy zawsze szczegółowo opisywać przebieg przeprowadzanego doświadczenia. Takie sprawozdanie powinno uwzględniać m.in. procedury przygotowywania badanego materiału oraz opis zastosowanych odczynników, tj. enzymów, buforów, barwników, w tym dane ich dostawców, numery katalogowe oraz oznaczenia klonów. Informacje te są niezbędne w przypadku kontroli i zapewniają wysoki stopień powtarzalności wyników.
Istotny jest również rodzaj badanej próbki, którą mogą być np. wyizolowane żywe komórki z krwi obwodowej, szpiku kostnego, biopsji tkankowej, węzła chłonnego, śliny, płynu mózgowo-rdzeniowego, popłuczyn pęcherzykowo- oskrzelowych, płynów ustrojowych z jam ciała itp.. Materiału do badań nie powinno się utrwalać ani mrozić, a sposób jego przechowywania należy uwzględnić w opisie.
Równie ważne są parametry samego cytometru przepływowego. W metodologii powinien się znajdować jego model, rodzaj użytego oprogramowania oraz dane producenta. Należy także wymienić linie laserowe i filtry emisji stosowane wraz z odpowiednimi odczynnikami fluorescencyjnymi.
Użycie wielu fluorochromów zwiększa ryzyko powstawania zakłóceń. Są one wynikiem nakładania się na siebie poszczególnych widm. Można tego uniknąć dzięki tzw. kompensacji, czyli zawężeniu spektrum detekcji do bardzo wąskiego zakresu fal. Funkcję tą ustawia się w cytometrze jeszcze podczas zbierania danych i należy ją uwzględnić w opisie doświadczenia, tak samo jak wielkość próbki, dane statystyczne oraz minimalny próg wykrywalności (ang. threshold) i metodę jego określenia.
Uzyskane wyniki można przedstawić na kilka sposobów. Zwykle są one ilustrowane w postaci wykresów jednowymiarowych (histogramów), dwuwymiarowych (kropkowy gęstości, konturowy) lub trójwymiarowych (perspektywicznych).
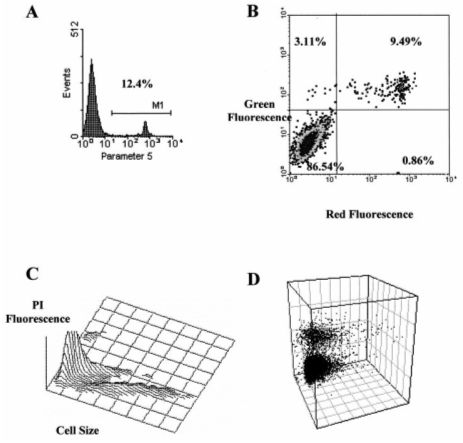
Rys. 3. Różne sposoby przedstawiania danych uzyskanych dzięki analizom z użyciem cytometrii przepływowej. A – jednowymiarowy histogram obrazujący stosunek wybranego parametru (oś X) do ilości badanych komórek (oś Y); B – wykres dwuwymiarowy ukazuje komórki rozproszone z zależności od intensywności emitowanego sygnału względem dwóch wybranych parametrów; komórki w lewym górnym rogu są pozytywne dla parametru z osi Y, komórki w górnym prawym rogu – dla obu parametrów, w lewym dolnym rogu – podwójnie negatywne, natomiast te w prawym dolnym rogu wykresu są pozytywne dla parametru z osi X; C i D – mniej powszechne wykresy trójwymiarowe mogą uwzględniać na osi Z różne parametry takie jak np. ilość komórek lub sygnał fluorescencji. (źródło: Álvarez-Barrientos A., Arroyo J., Cantón R., Nombela C,Sánchez-Pérez M., 2000. Applications of Flow Cytometry to Clinical Microbiology. Clinical Microbiology Reviews 13(2): 167–195).
Wykorzystanie cytometrii przepływowej
Cytometria przepływowa umożliwia ilościowe określenie populacji i subpopulacji komórek, ich cech morfologicznych oraz stanów czynnościowych. Pojawienie się technologii produkcji przeciwciał monoklonalnych i ich łączenia z barwnikami fluorescencyjnymi umożliwiło szybką ocenę immunofenotypu związanego z obecnością antygenów zlokalizowanych na powierzchni błony komórkowej. Dzięki zwiększeniu przepuszczalności plazmolemmy (tzw. permeabilizacji) można również dokonywać oceny antygenów cytoplazmatycznych i jądrowych.
Istotna jest nie tylko informacja o obecności lub braku określonego markera, ale także dane dotyczące jego gęstości na powierzchni komórki. Analizy tego typu dokonuje się porównując intensywność fluorescencji badanych cząstek z intensywnością świecenia mikrokuleczek (ang. beads) sprzężonych z różnymi, znanymi ilościami fluorochromu. Technika ta wyznaczyła nowe kierunki badawcze w medycynie, głównie w immunologii i onkologii.
Ocena immunofenotypu komórek znalazła zastosowanie w diagnostyce m.in. ostrych i przewlekłych białaczek, chłoniaków, zespołów mielodysplastycznych i mieloproliferacyjnych, nowotworów kości, głowy i szyi. Jej zastosowanie umożliwia często właściwy dobór stosowanej terapii, określenie stopnia reemisji oraz wykrywanie tzw. choroby resztkowej (ang. minimal residual disease, MRD), czyli nieznacznych ilości komórek nowotworowych, które pozostając w ustroju stanowią przyczynę nawrotów choroby. Metoda cytometrii przepływowej pozwala wykryć resztkowe komórki blastyczne u pacjentów, którzy pod względem morfologicznych kryteriów wydają się być w całkowitej reemisji.
Technika ta umożliwia również badanie cyklu mitotycznego komórek nowotworowych z oceną ploidii DNA i rozkładu niektórych białek np. cyklin. Pozwala to na określenie ich potencjału proliferacyjnego i może wskazywać na tendencję do formowania się przerzutów. Ustalenie niekorzystnych immunofenotypów ułatwia szybką i obiektywną diagnostykę oraz wyodrębnienie wśród chorych grupy tzw. zwiększonego ryzyka, u której zalecane jest stosowanie bardziej agresywnego leczenia.
Cytometra przepływowa odgrywa również istotną rolę przy określaniu tzw. oporności wielolekowej (ang, multidrag resistance – MDR) podczas chemioterapii m.in. metotrexatem, doksorubicyną, daunoribicyną. Monitorowanie przebiegu leczenia możliwe jest dzięki ocenie przepływu jonów i leków przez plazmolemmę i błony organelli.
Metoda ta znalazła także zastosowanie w diagnostyce niektórych chorób autoimmunizacyjnych (np. reumatoidalnego zapalenia stawów, zespołu Sjögrena, cukrzycy typu I, zapalenia tęczówki, autoimmunologicznego zapalenie wątroby) i chorób płuc (m.in. nowotworów, sarkoidozy, histiocytozy X). Wykorzystuje się ją również w diagnostyce chorób układu oddechowego (nowotwory płuc, rak krtani), przy monitorowaniu stanu chorych po tonsillektomii, w badaniach kłykcin kończystych oraz diagnostyce schorzeń przewodu pokarmowego (wrzodziejącego zapalenia jelit, choroby Leśniowskiego- Crohna). Cytometra przepływowa przyczyniła się również do znacznego postępu w ocenie immunomorfologicznej i czynnościowej komórek biorących udział w mechanizmach obronnych. Wykorzystywane jest to w diagnostyce niedoborów odporności m.in. zespołu nabytego niedoboru immunologicznego AIDS, w którym istotna jest ocena ilościowa populacji CD4+ i CD8+.
W mikrobiologii cytometria pozwala na szybkie wykrywanie i wstępną identyfikację mikroorganizmów odpowiedzialnych za infekcję. Jej wielką zaletą jest możliwość analizowania mieszanych populacji, które w różny sposób odpowiadają na czynniki antybakteryjne. Pozwala ona również testować odpowiedź immunologiczną u pacjentów, wykrywać specyficzne przeciwciała oraz monitorować stan kliniczny chorego już po zakończonym leczeniu.
W transplantologii technika ta stosowana jest podczas oznaczania ludzkich antygenów leukocytarnych (ang. human leukocyte antigens – HLA) na powierzchni komórek dawcy i biorcy oraz przy tzw. próbie krzyżowej (ang. crossmatch), czyli ocenie obecności w surowicy biorcy przeciwciał cytotoksycznych dla komórek dawcy. Kontrolne badania subpopulacji limfocytów u pacjenta po przeszczepie dostarczają danych o stanie jego układu immunologicznego i pozwalają określić skuteczność stosowanej terapii immunosupresyjnej.
W immunologii porównawczej cytometria służy do analizy wielkości i ziarnistości komórek oraz odzwierciedlania etapu cyklu podziałowego. Stosuje się ją także w ocenie morfologii i czynności płytek krwi i neutrofilów.
W alergologii służy ona do oceny efektywność terapii odczulającej polegającej na cytofluorymetrycznej analizie poziomu limfocytów pomocniczych o fenotypie Th1 i Th2 lub za pomocą oceny stopnia degranulacji bazofilów.
Badanie komórek roślinnych
Cytometria przepływowa może być wykorzystywana do oznaczania zawartości DNA i badania cyklu komórkowego również w tkankach roślinnych. Jest to metoda szeroko stosowana przez cytogenetyków, botaników, systematyków, biotechnologów, hodowców roślin, a także producentów nasion.
Stosując ją można określić wielkość genomu i ploidaność roślin, poziom endoreplikacji (polisomatyczność, tzn. obecność w organie /tkance komórek o różnej zawartości DNA, powstające w trakcie różnicowania się komórek) oraz proporcję jąder będących w określonych fazach cyklu komórkowego (aktywność cyklu komórkowego). Do tego rodzaju badań stosuje się pomiar jednego parametru, a uzyskane dane przedstawia się w postaci histogramu. Najczęściej stosowanymi barwnikami fluorochromowymi są: DAPI (indolo-4’,6-dwuamidyno-2-fenyloidyna) oraz jodek propidyny – PI.
Analizom można poddawać dowolne części roślin zawierające jądra komórkowe. Najbardziej wiarygodne są wyniki uzyskane dzięki analizom świeżego materiału, jednak w tym wypadu do badań nadają się również tkanki zamrożone, utrwalone, a nawet wysuszone. Przed analizą próbkę poddaje się izolacji protoplastów (z nieuszkodzoną błoną komórkową) lub jąder.
Autor: Anna Kurcek
Literatura:
1. Baran J., 2008. Nowa epoka cystometrii przepływowej – przewodnik po współczesnych cytometriach i ich zastosowanie. Postępy Biologii Komórki 35 (24): 3-15.
2. Burchardt D., Machowska L., Derwich K., Samara H., Dworacki G., 2008. Cytometria przepływowa – możliwości zastosowania w diagnostyce klinicznej zmian w obrębi jamy ustnej. Nowiny Lekarskie 77 (4): 324–329.
3. Śliwińska E., 2008. Zastosowanie cystometrii przepływowej do oznaczania zawartości DNA u roślin. Postępy Biologii Komórki 35 (24): 165-176.
4. Alvarez D. F., Helm K., DeGregori J., Roederer M., Majka S., 2010. Publishing flow cytometry data. American Journal of Physiology – Lung Cellular and Molecular Physiology 298(2): 127–130.
5. Álvarez-Barrientos A., Arroyo J., Cantón R., Nombela C,Sánchez-Pérez M., 2000. Applications of Flow Cytometry to Clinical Microbiology. Clinical Microbiology Reviews 13(2): 167–195.
6. Kaczmarek A., Mackiewicz A., Leporowska E., Osawa T., 2002. Rola i miejsce cytometrii przepływowej w diagnostyce klinicznej.Współczesna Onkologia 6 (6): 366-373.

