Systematyka enzymów została wprowadzona w 1961 r. decyzją Międzynarodowej Unii Biochemicznej. Obecnie enzymy dzielimy na 6 podstawowych klas, z których każda dzieli się na podklasy, a te z kolei na podpodklasy. Celulazy należą do 3 klasy enzymów- hydrolaz, które rozkładają wiązania chemiczne z udziałem cząsteczki wody. Hydrolizują one wiązania β (1-4) glikozydowe w celulozie. Celuloza to polisacharyd zbudowany z łańcuchów utworzonych z jednostek β-D-glukozy połączonych wiązaniami β-1,4-glikozydowymi. Podstawową jednostką powtarzającą się w łańcuchu celulozy jest dwucukier celobioza.
Celulaza to nazwa zbiorcza dla trzech podstawowych frakcji enzymów: endo-beta-l,4-glukanazy, która katalizuje reakcję hydrolizy wewnątrzcząsteczkowych wiązań β -1,4 w wyniku czego powstają łańcuchy o wolnych końcach, egzo-beta-l,4-glukanazy odszczepiającej jednostki disacharydu celobiozy od glukozy oraz β-glukozydazy (celobiozy) która katalizuje reakcję rozkładu celobiozy do dwóch cząsteczek glukozy i odszczepia cząsteczki glukozy od nieredukujących końców celooligosacharydów. Ponadto w obrębie celulaz możemy wyróżnić kilka enzymów o różnej specyficzności np. celulaza C1 hydrolizująca celulozę naturalną o nienaruszonych włóknach, nierozpuszczalna w wodzie celulaza C2 działająca na celulozę modyfikowaną oraz celulaza Cx katalizująca reakcję hydrolizy dekstynocelulozy będącej rozpuszczalną w wodzie zmodyfikowaną formą celulozy.
Do organizmów, które mają zdolność hydrolizowania celulozy a tym samym posiadają kompleks celulaz zaliczamy: bakterie (Cytophaga, Cellvibrio, Sorangium, beztlenowy Clostridium thermocellum), grzyby (np. z rodzaju Fusarium, Chaetomium, Trichoderma), pierwotniaki (Entodinium, Diplodinium), zwierzęta bezkręgowe (owady, mięczaki, pierścienice) i parazytofity (wyższe rośliny pasożytnicze, np. z rodziny Cuscutaceae, Scrophulariaceae, Orobanchaceae).
Zastosowanie celuloz
Enzymy posiadają szereg różnych cech, które decydują o ich celowym wykorzystaniu. Do głównych właściwości enzymów, które pozwalają na zastosowanie preparatów enzymatycznych w przemyśle możemy zaliczyć ich naturalne pochodzenie, nietoksyczność, neutralność wobec właściwości organoleptycznych produktu oraz wyjątkowo wysoką aktywność katalityczną. Obecnie jedynie w przemyśle spożywczym wykorzystywanych jest około 100 enzymów, a ich liczba rośnie z roku na rok, ze względu na ogromny postęp w dziedzinie biotechnologicznej syntezy enzymów, który przyczynia się do obniżenia kosztów samych preparatów enzymatycznych. Jednym z głównych zastosowań celulaz jest maceracja miazgi owoców i warzyw, która ułatwia tłoczenie i zwiększa uzysk soku. Celulazy mogą być również wykorzystywane jako składniki pasz. Częściowo hydrolizują ściany komórek roślinnych, dzięki czemu zwiększają ich strawność i wartość odżywczą. Wyniki badań wskazują, że wprowadzenie preparatów enzymatycznych zawierających m.in. celulazy do diety bydła zwiększa ciężar masy ciała i wydajność mleka. Celulazy stosowane są również w celu polepszenia fermentacji, filtracji i jakości piwa, a także poprawiają uwalnianie aromatu w winach. Celulazy mogą być wykorzystywane do zmiękczania i wygładzania tkanin, a także do produkcji proszków do prania. Od kilku lat enzymy w tym celulazy stosuje się również jako biokatalizatory w syntezie organicznej.
Synteza polimerów z użyciem celulaz
Dopiero pod koniec XX wieku Kobayashi i współpracownicy otrzymali syntetyczną celulozę metodą polireakcji enzymatycznej. Substratem w reakcji syntezy celulozy był fluorek β-cellobiosylu, łatwo rozpoznawalny przez celulazę w reakcji jego hydrolizy.
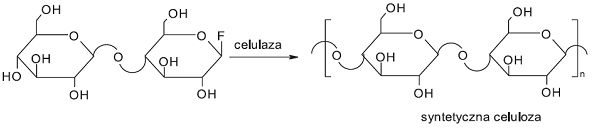
Rys.1 Synteza celulozy z udziałem celulazy (1).
W reakcji polikondensacji powstaje syntetyczna celuloza, która posiada strukturę podobną do celulozy naturalnej. W ten sposób otrzymujemy dwie formy krystaliczne celulozy I i II. Celuloza I jest metastabilna, ma strukturę równolegle ułożonych łańcuchów polisacharydu zaś celuloza II jest formą termodynamicznie stabilną i posiada strukturę przeciwlegle ułożonych łańcuchów.
Celulaza jako czynnik warunkujący patogeniczność Clavibacter michiganensis
Celulazy są jednym z najważniejszych czynników warunkujących patogeniczność Clavibacter michiganensis, który powoduje zakażenia roślin wywołując m.in. bakteriozę pierścieniową ziemniaka czy raka bakteryjnego pomidora. Enzymy te warunkują przenikanie patogena do tkanek roślinnych a także pozwalają na wykorzystanie celulozy jako źródła węgla. Celulazy bakteryjne to zewnątrzkomórkowe białka, które na podstawie budowy części katalitycznej są zakwalifikowane do rodziny celulaz A określanych mianem hydrolaz glikozylowych. Cechą charakterystyczna celulaz wytwarzanych przez bakterie Clavibacter michiganensis jest budowa domeny C-terminalnej określanej jako Dom 3, która przypomina domeny roślinych α-ekspansyn – białek indukujących wzrost komórkowy poprzez degradację wiązań miedzy glikanami. Aktywność celulaz jest niezbędna do wywołania objawów chorobowych. Wynikiem działania tego enzymu jest zmniejszenie grubości kanałów w ksylemie oraz brak integralności ścian komórek budujących ksylem. Prowadzi to do zablokowania naczyń przewodzących, upośledzenie transportu wody a w konsekwencji więdnięcie i zamieranie zainfekowanej rośliny.
Autor: Beata Rola
Literatura:
1. Rokicki G. 2005: Synteza polimerów z użyciem enzymów. Biotechnologia 2: 48-68
2. Beguin P., Aubert J.P. 1994: The biological degradation of cellulose. FEMS Microbiol. Rev. 13: 25-58
3. Nowak D. 2008: Enzymy jako nowoczesne narzędzie technologiczne. Agro przemysł 2: 28-30
4. Waleron M., Skrzypkowska M., Waleron K., Łojkowska E. 2010: Epidemiologia wybranych podgatunków bakterii Clavibacter michiganensis oraz metody ich identyfikacji i zwalczania. Post. Mikrobiol. 49: 269-284
5. Szczech M. Grzyby Trichoderma – dlaczego warto się nimi zainteresować? Instytut Warzywnictwa im. Emila Chroboczka w Skierniewicach, http://trichoderma.iwarz.pl/?d=informacje_o_trichoderma&id=117

