PRZEDRUK, oryginał dostępny pod adresem www
Opracowała: dr inż. Agnieszka Październiok-Holewa
Politechnika Śląska (www)
Wydział Chemiczny (www)
Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii (www)
Kierownik Katedry: dr hab. inż. Mirosław Gibas prof. Politechniki Śląskiej
Adres:
ul. B. Krzywoustego 4
44-100 Gliwice
Bezpośrednia redukcja aromatycznych związków nitrowych stanowi ważną reakcję otrzymywania amin aromatycznych, będących cennymi reagentami stosowanymi w syntezie organicznej. Redukcję tą przeprowadza się metodą katalitycznego uwodornienia lub za pomocą wielu odczynników, np.: metali (Zn, Sn, Fe lub nieraz inny metal) w obecności kwasu, siarczków ( NaHS lub (NH4)2S) lub hydrazyny wobec katalizatora. Selektywną redukcję 1,2-dinitrobenzenu i 2,4-dinitroanizolu, odpowiednio, do 2-nitroaniliny i 2-metoksy-5-nitroaniliny można przeprowadzić zarówno metodą katalitycznego uwodornienia, jak również w przypadku 1,2-dinitrobenzenu używając siarczku amonu (Schemat 1, Schemat 2).
Alternatywą w stosunku do opisanych powyżej chemicznych metod redukcji jest redukcja aromatycznych związków nitrowych z użyciem biokatalizatora. Reakcja ta charakteryzuje się wysoką regio- i chemoselektywnością.
Przemianę nitrobenzenu do aniliny z udziałem drożdży piekarskich zaobserwowali po raz pierwszy Neuberg i Welde już w 1914 roku. Wśród wielu mikroorganizmów drożdże piekarskie (Saccharomyces cerevisiae, ang. bakers’ yeast) stanowią cenny biokatalizator. Swoją popularność zawdzięczają nieograniczonej dostępności (światowa produkcja ok. 600 ton/rok), niskiej cenie oraz łatwości hodowli (nie jest konieczne doświadczenie mikrobiologiczne, sterylne warunki ani specjalistyczne wyposażenie). Reakcje za pomocą drożdży wykonuje się w warunkach fermentacyjnych w środowisku wodnym lub w rozpuszczalnikach organicznych. W warunkach wodnych żywe komórki syntezują i regenerują enzymy i kofaktory, niezbędne do prowadzenia metabolizmu, co umożliwia zredukowanie ilości drożdży, ale często komplikuje izolację produktu lub nie daje zastosować się do nierozpuszczalnych w wodzie substratów. W środowisku organicznym wykorzystuje się wyłącznie zawarte w komórkach enzymy i kofaktory bez możliwości ich regeneracji, co narzuca konieczność zwiększenia ich ilości.
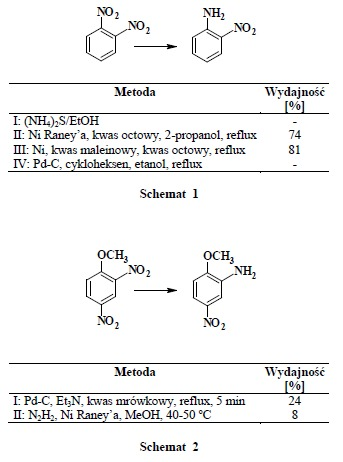
Badania wykazały, że przebieg redukcji monopodstawionych nitrobenzenów silnie zależy od charakteru podstawnika. Jeśli związek zawiera grupę elektronodonorową (np.: NH2, OH, SH, OCH3, CH3, Br) to wydajność reakcji redukcji jest niska lub w ogóle ona nie zachodzi. Jeżeli podstawnik ma charakter elektronoakceptorowy (np.: NO2, CN, CF3, COOEt) redukcja nitrobenzenów zachodzi łatwo z dobrymi wydajnościami. Przykładem tego jest katalizowana drożdżami redukcja 1,2-dinitrobenzenu, w rezultacie której powstaje 2-nitoranilina z wysoką wydajnością, porównywalną z wydajnościami otrzymywanymi w redukcji metodami chemicznymi (Schemat 3).
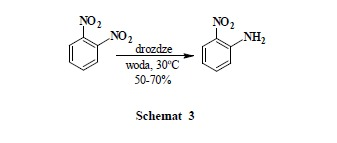
Prowadząc w analogicznych warunkach selektywną redukcję 2,4-dinitroanizolu otrzymać można 2-metoksy-5-nitroaniliną z wydajnością wyższą niż otrzymana metodami chemicznymi (Schemat 4).
Część eksperymantalna
Zagrożenia: Nitrobenzen i anilina oraz ich pochodne są substancjami działającymi toksycznie na organizm ludzki przez drogi oddechowe oraz skórę. ŚRODKI OSTROŻNOŚCI: W czasie pracy należy zachować ostrożność!!! Stosuj ubranie ochronne (fartuch), rękawice ochronne oraz okulary.
Ćwiczenie A. Redukcja 1,2-dinitrobenzenu do 2-nitroaniliny przy użyciu drożdży piekarskich (Schemat 3)
Odczynniki:
– 1,2-dinitrobenzen (1,49 mmola, 0,25 g)
– drożdże piekarskie (Saccharomyces cerevisiae), (50 g)
– woda destylowana (100 cm3)
– alkohol etylowy (2,5 – 4 cm3)
– Celite ® lub Hyflo supercel
– octan etylu
– eter naftowy
– 2 molowy wodny roztwór wodorotlenku sodu
– chlorek sodu
– wata
Wykonanie:
1) W kolbie Erlenmayera o pojemności 300 cm3 umieść 100 cm3 wody destylowanej oraz 25 g suchych drożdży (lub 50g drożdży Babuni) . Następnie delikatnie zatkaj szyję kolby korkiem z waty i umieść kolbę w cieplarce w temperaturze 300C na 2 – 3 godziny, od czasu do czasu wstrząsając zawartością kolby.
2) Odważ 0,25 g 1,2-dinitrobenzenu i umieść w probówce, następnie rozpuść w minimalnej ilości alkoholu etylowego, a otrzymany roztwór wlej w sam środek mieszaniny wyjętej z cieplarki i dokładnie wymieszaj.
3) Ponownie kolbę umieść w cieplarce w temperaturze 300C (200 obr./min.) na 24 godziny.
4) Po zakończeniu reakcji do mieszaniny reakcyjnej dodaj celit (17,5 – 15 g) i pozostaw na 30 minut od czasu do czasu mieszając. Następnie zawiesinę przesącz na lejku Büchnera przez złoże mokrego celitu (1 cm) z dwoma sączkami, a pozostałe na lejku drożdże przemyj wodą destylowaną (50 cm3). Odczyn przesączu doprowadź do pH = 7 za pomocą 2 molowego wodnego roztworu NaOH, a następnie nasyć go stałym NaCl.
5) Oddzielone drożdże przemyj octanem etylu (2 ×50 cm3), a otrzymany przesącz użyj do ekstrakcji roztworu wodnego nasyconego NaCl z pkt. 4. 6) Metodą TLC sprawdź czy w ekstahowanej fazie wodnej znajduje się jeszcze pożądany produkt. Jeżeli faza wodna zawiera 2-nitroanilinę to należy powtórzyć ekstrakcję jeszcze jedną porcją octanu etylu (50 cm3).
7) Ekstrakty organiczne połącz i wysusz bezwodnym siarczanem (VI) magnezu. Następnie środek suszący odsącz, a otrzymany roztwór mieszaniny reakcyjnej zatęż na wyparce rotacyjnej do objętości ok. 4 – 5 cm3. Skład mieszaniny reakcyjnej sprawdź metodą TLC [układ rozwijający: eter naftowy/octan etylu, 1:1 (v/v); 1,2-dinitrobenzen Rf = 0,4 (w świetle lampy UV), 2-nitroanilina Rf = 0,55 (jasnożółta plamka widoczna w świetle dziennym)].
8) Wyciągnij wnioski z przeprowadzonej analizy TLC.
9) Surowy produkt można oczyścić metodą chromatografii kolumnowej [eluent: eter naftowy/octan etylu 10:1 następnie 4:1 (v/v)]. Wydajność teoretyczna uzyskanej 2-nitroaniliny o temp. topnienia 72-74 oC (pomarańczowe igły) wynosi 54% (0,11 g).
Ćwiczenie B. Redukcja 2,4-dinitroanizolu do 2-metoksy-5-nitroaniliny przy użyciu drożdży piekarniczych (Schemat 4)
Odczynniki:
– 2,4-dinitroanizol (1,26 mmola, 0,25 g)
– drożdże piekarskie (Saccharomyces cerevisiae), (35,5 g)
– woda destylowana (100 cm3)
– alkohol etylowy (2,5 cm3)
– Celite ®
– octan etylu
– 2 molowy wodny roztwór wodorotlenku sodu
– chlorek sodu
– wata
Wykonanie:
1) W kolbie Erlenmayera o pojemności 300 cm3 umieść 100 cm3 wody destylowanej oraz 35,5 g suchych drożdży (lub 70 g drożdży Babubni) suchych drożdży. Następnie delikatnie zatkaj szyję kolby korkiem z waty i umieść kolbę w cieplarce w temperaturze 300C na 2 godziny, od czasu do czasu wstrząsając zawartością kolby.
2) Odważ 0,25 g 2,4-dinitroanizolu i umieść w probówce, następnie rozpuść w minimalnej ilości alkoholu etylowego, a otrzymany roztwór wlej w sam środek mieszaniny wyjętej z cieplarki i dokładnie wymieszaj.
3) Ponownie kolbę umieść w cieplarce w temperaturze 300C (200 obr./min.) na 60 godzin.
4) Do mieszaniny dodaj kolejną porcję suchych drożdży (10 g) i inkubację mieszaniny prowadź w temperaturze 300C w cieplarce przez kolejne 24 godziny.
5) Po zakończeniu reakcji do mieszaniny reakcyjnej dodaj celit (5 g) i pozostaw na 30 minut od czasu do czasu mieszając. Następnie zawiesinę przesącz na lejku Büchnera przez 5 cm złoże mokrego celitu z dwoma sączkami. W razie konieczności odczyn przesączu doprowadź do pH = 7 za pomocą 2 molowego wodnego roztworu NaOH, a następnie nasyć go NaCl.
6) Oddzielone drożdże przemyj kilkoma porcjami octanu etylu (całość ok. 150 cm3), a otrzymany przesącz użyj do ekstrakcji roztworu wodnego nasyconego NaCl z pkt. 5.
7) Fazę wodną poddaj ponownie ekstrakcji świeżą porcją octanu etylu (100 cm3).
8) Ekstrakty organiczne połącz i wysusz bezwodnym siarczanem (VI) magnezu. Środek suszący odsącz, a uzyskamy roztwór mieszaniny reakcyjnej zatęż na wyparce rotacyjnej do objętości ok. 4 – 5 cm3. Skład mieszaniny reakcyjnej sprawdź metodą TLC [układ rozwijający: eter naftowy/octan etylu, 2:1 (v/v); 2-metoksy-5-nitroanilina Rf = 0,42 (w świetle lampy UV i jasno żółta plamka widoczna w świetle dziennym), 2,4-dinitrobenzen Rf = 0,35 (w świetle lampy UV), 4-metoksy-5-nitroanilina Rf = 0,21 (w świetle lampy UV i jasno żółta plamka widoczna w świetle dziennym)].
9) Wyciągnij wnioski z przeprowadzonej analizy TLC.
10) Surowy produkt można oczyścić metodą chromatografii kolumnowej [eluent: eter naftowy/octan etylu 4:1 (v/v)]. Wydajność uzyskanej 2-metoksy-5-nitroaniliny (pomarańczowe igły) wynosi 39% (0,06 g) o temperaturze topnienia 114,5 – 1150C.

