PRZEDRUK, oryginał dostępny pod adresem www
Tytuł oryginalny: Materiały dodatkowe – związki heterocykliczne
Autor: dr Marek Żylewski
Uniwersytet Jagielloński (www)
Wydział Farmaceutyczny Collegium Medicum (www)
Katedra Chemii Organicznej (www)
Kierownik: Prof. UJ, dr hab. Marek Cegła
Adres:
ul. Medyczna 9
30-688 Kraków
Kontakt: tel. 012 620 55 00
1. Nasycone i częściowo nasycone układy heterocykliczne (związki niearomatyczne).
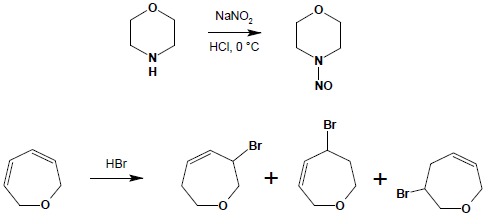
Związki te pod względem chemicznym zachowują się jak ich łańcuchowe odpowiedniki – związki zawierające azot – jak aminy lub iminy, tlen – jak etery itd. W przypadku obecności wiązań podwójnych należy zawsze rozważyć możliwość reakcji addycji do układów sprzężonych – jeśli taka istnieje:
2. Pięcioczłonowe układy heteroaromatyczne.
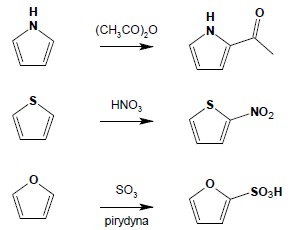
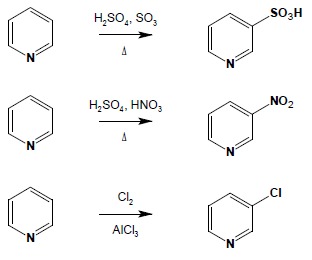
Układy te charakteryzuje zwiększona gęstość elektronowa w stosunku do benzenu, zatem reakcje substytucji elektrofilowej są w sposób zdecydowany ułatwione i zachodzą w bardzo łagodnych warunkach. Ze względu na wrażliwość tych układów na działanie silnych kwasów (pod ich wpływem układy te wykazują tendencję do polimeryzacji lub rozpadowi z otwarciem pierścienia) podczas prowadzenia tych reakcji unika się stosowania silnych kwasów – nitrowanie przeprowadza się w obecności bezwodnika octowego, sulfonowanie – często używając trójtlenku siarki w pirydynie (zatem w warunkach zasadowych), do reakcji acylowania Friedela-Craftsa nie stosuje się katalizatora, który jest silnym kwasem Lewisa:
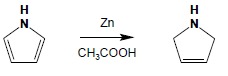
Jak wskazują powyższe przykłady, nowy podstawnik w substytucji elektrofilowej jest kierowany w pozycję 2 lub 5. Wyjaśnienie tego zjawiska można uzyskać rozpatrując odpowiednie struktury mezomeryczne przejściowego kompleksu σ. Gdyby obie te pozycje były jednak zajęte możliwa jest również substytucją w pozycje 3,4. Pięcioczłonowe układy heterocykliczne charakteryzuje ponadto bardzo duża wrażliwość na działanie środków utleniających. Związki te utleniają się już tlenem z powietrza do ciemnozabarwionych, polimerycznych pochodnych. Redukcja jest możliwa zarówno na drodze katalitycznej (do układów nasyconych) lub do dihydropochodnych:
3. Sześcioczłonowe układy aromatyczne.
W tym przypadku obserwuje się znaczne zmniejszenie gęstości elektronowej w pierścieniu na skutek indukcyjnego wpływu heteroatomu, posiadającego znacznie większą elektroujemność od atomów węgla. W rezultacie reakcje substytucji elektronowej są bardzo utrudnione i wymagają użycia drastycznych warunków a i tak wydajności reakcji nie są zbyt duże. Możliwe są reakcje fluorowcowania, nitrowania i sulfonowania, natomiast reakcje ze słabszymi elektrofilami – takie jak np. reakcje Friedela-Craftsa w ogóle nie są możliwe do przeprowadzenia. Nowy podstawnik kierowany jest w pozycję 3,5 układu:
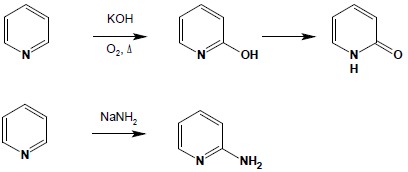
Dla układu pirydyny bardzo duże znaczenie mają reakcji substytucji nukleofilowej. Możliwe jest wprowadzenie w ten sposób grupy hydroksylowej (produkt ulega tautomerii w formę ketonową) lub aminowej (reakcja Cziczibabina):
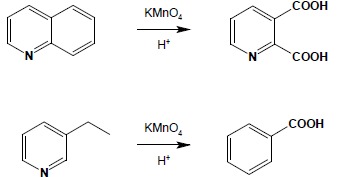
Sześcioczłonowe układy aromatyczne są bardzo odporne na reakcje utleniania. Przykładem jest tu utlenianie chinoliny – zachowany zostaje pierścień pirydynowy a utlenieniu ulega pierścień benzenowy. Możliwa jest reakcja analogiczna do reakcji alifatycznych pochodnych benzenu. Podobnie jak w tamtym przypadku alifatyczne pochodne pirydyny lub jej analogów ulegają utlenieniu w łańcuchu bocznym do odpowiednich kwasów karboksylowych.
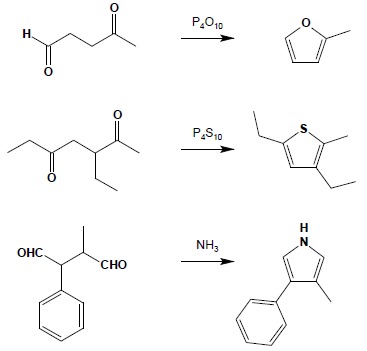
4. Synteza układów heterocyklicznych. Reakcją ogólną stosowaną do otrzymywania furanu, pirolu czy tiofenu jest reakcja związków 1,4-dikarbonylowych odpowiednio z P4O10, NH3 czy P4S10:
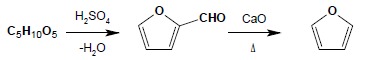
Furan można otrzymać w dwuetapowej syntezie wychodząc z dowolnej pentozy:
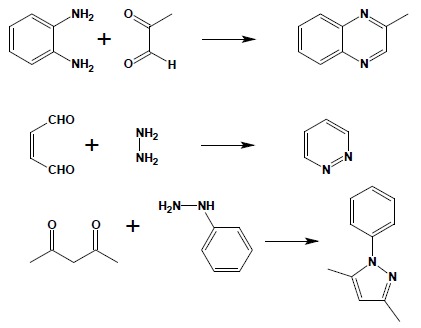
Układy heterocykliczne, zawierające azot można łatwo otrzymywać w reakcjach kondensacji związków karbonylowych z odpowiednimi aminami czy pochodnymi hydrazyny:
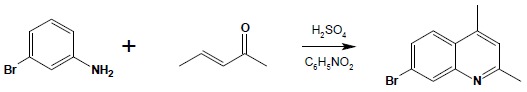
Specyficznym typem reakcji kondensacji używanej do otrzymywania układów heterocyklicznych jest otrzymywanie chinoliny i pochodnych w reakcji Skraupa. Jest to reakcja aniliny (lub jej pochodnych, mających przynajmniej jedną pozycję orto wolną i nieposiadających podstawników silnie dezaktywujących pierścień – np. grupy nitrowej) z α,β-nienasyconymi związkami karbonylowymi. Reakcja przebiega jako addycja 1,4 grupy aminowej do sprzężonego układu wiązań podwójnych nienasyconego związku karbonylowego, następnie zachodzi zamknięcie pierścienia pirydynowego do dihydrochinoliny i, w ostatnim etapie, utlenienie do układu aromatycznego:
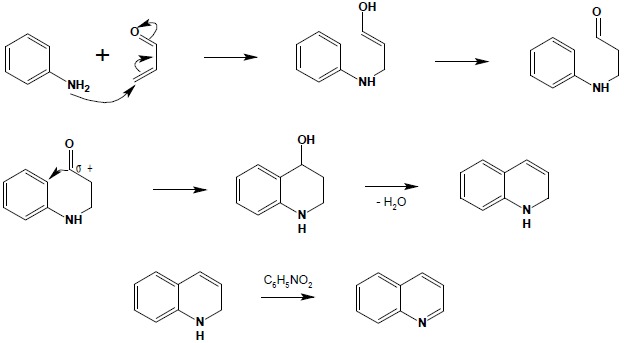
Reakcję prowadzi się bez wyodrębniania produktów pośrednich. Zastosowanie różnych związków wyjściowych pozwala na otrzymywanie szeregu różnych pochodnych chinoliny: