PRZEDRUK, oryginał dostępny pod adresem www
Uniwersytet Gdański (www)
Wydział Chemii (www)
Katedry Chemii Bioorganicznej (www)
Kierownik: Prof. dr hab. Krzysztof Rolka
Adres:
ul. Sobieskiego 18/19
80-952 Gdańsk
Kontakt: tel. 58 52 35 386
____________________________________________________________________________
L-DOPA (L-3,4-dihydroksyfenyloalanina) jest naturalnym prekursorem dopaminy, jednego z najważniejszych neurotransmiterów wykorzystywanych przez neurony ssaków, a także adrenaliny i noradrenaliny, syntetyzowanych zarówno w ośrodkowym układzie nerwowym jak i w tkankach obwodowych. W większości komórek zdolnych do syntezy amin katecholowych, L-DOPA jest wytwarzana z tyrozyny w reakcji katalizowanej przez hydroksylazę tyrozynową (HT, rys. 1), a następnie przekształcana w dopaminę przez dekarboksylazę DOPA (AADC). Dopamina może być następnie wykorzystana do syntezy noradrenaliny i adrenaliny w reakcjach katalizowanych przez hydroksylazę dopaminową (DBH) oraz N-metylotransferazę fenyloetanoloaminową (PNMT).
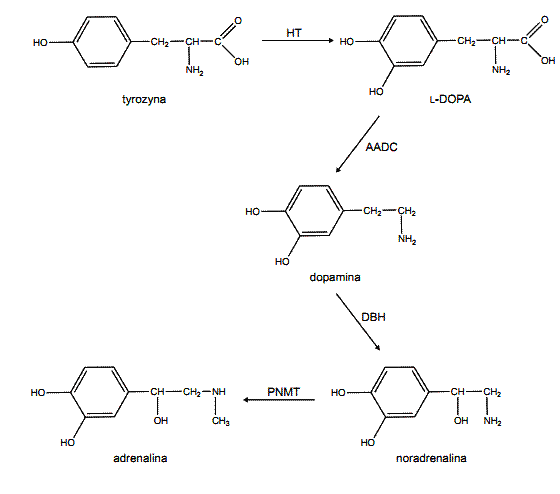
Rys. 1. Schemat biosyntezy amin katecholowych w organizmie ludzkim.
HT – hydroksylaza tyrozynowa
AADC – dekarboksylaza DOPA
DBH – hydroksylaza dopaminowa
PNMT – N-metylotransferaza fenyloetanoloaminowa
L-DOPA jest podstawowym i najbardziej skutecznym środkiem stosowanym w terapii choroby Parkinsona – schorzenia zwyrodnieniowego układu nerwowego, na które cierpi około 1,5 % osób w wieku powyżej 65 lat. Przyczyny choroby Parkinsona nie zostały dotychczas w pełni wyjaśnione, aczkolwiek wiadomo, że obserwowane objawy: drżenie rak, ramion, żuchwy i twarzy, sztywność kończyn i tułowia, spowolnienie ruchów, upośledzenie koordynacji ruchowej i równowagi są wynikiem obumierania neuronów istoty czarnej mózgu (tzw. neuronów dopaminergicznych) odpowiedzialnych za produkcję dopaminy. Podstawową metodą produkcji L-DOPA w przemyśle farmaceutycznym jest synteza chemiczna. W latach 90-tych minionego wieku zintensyfikowały się badania nad wykorzystaniem mikroorganizmów lub preparatów enzymatycznych w produkcji tego leku. Jednak biosynteza L-DOPA z użyciem bakterii lub grzybów okazała się dość kosztowna, głównie ze względu na konieczność usuwania dużych ilości zanieczyszczeń powstających w procesie produkcyjnym, a przez to niekonkurencyjna w porównaniu z syntezą chemiczną. Z drugiej strony prace nad wykorzystaniem enzymu – tyrozynazy, jako biokatalizatora reakcji przekształcenia aminokwasu tyrozyny w L-DOPA wskazały na wyraźną opłacalność ekonomiczną takiego podejścia, szczególnie w świetle dużej trwałości enzymu i łatwości jego oddzielenia od mieszaniny reakcyjnej.
Tyrozynaza (EC 1.14.18.1) jest enzymem szeroko rozpowszechnionym w organizmach żywych. Obecność tego enzymu stwierdza się zarówno w mikroorganizmach, jak i komórkach roślinnych. Natomiast w organizmach ssaków największą aktywność tyrozynazy wykrywa się w melanocytach, gdzie jest ona kluczowym enzymem szlaku syntezy melaniny, barwnika nadającego charakterystyczne zabarwienie skóry.
Tyrozynaza może katalizować dwie różne reakcje chemiczne:
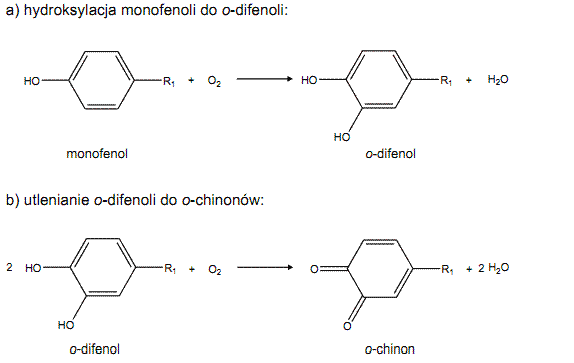
Spośród różnorodnych związków chemicznych o charakterze monofenoli, tyrozyna wydaje się być najważniejszym substratem tyrozynazy. Enzym ten wydajnie hydroksyluje tyrozynę do L-DOPA (odifenol), a następnie umożliwia przekształcenie cząsteczek L-DOPA do dopachinonów (o-chinon). Proces powstawania dopachinonów można zablokować przez dostarczenie do środowiska reakcji związków chemicznych o właściwościach silnie redukujących np. askorbinianu lub NADH, co sprawia, że jedynym produktem reakcji katalizowanej przez tyrozynazę jest L-DOPA. Możliwość tę wykorzystuje się w procesie enzymatycznej produkcji L-DOPA, a pomiar ilości powstającej LDOPA w czasie pozwala określić aktywność użytej tyrozynazy.
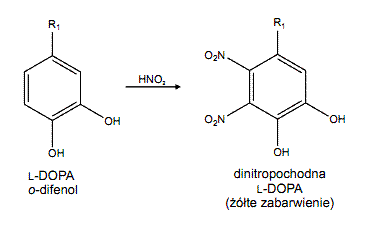
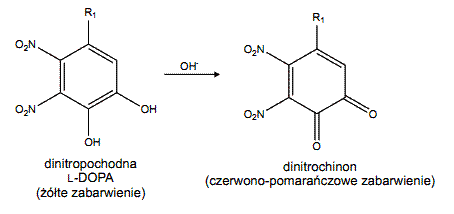
Powszechnie stosowaną, czułą i prostą metodą detekcji oraz ilościowego oznaczania L-DOPA w próbach nie zawierających innych o-difenoli (np. adrenaliny, 2,3-dihydroksybenzoesanu) jest chemiczne przekształcenie tego aminokwasu do dinitrochinonu. Ponieważ powstały związek charakteryzuje się intensywnym, czerwono-pomarańczowym zabarwieniem możliwe jest oznaczenie jego zawartości metodami spektrofotometrycznymi (λ = 460 nm). Proces derywatyzacji L-DOPA do dinitrochinonu przebiega w dwóch kolejnych reakcjach chemicznych:
a) nitrowania L-DOPA do nitropochodnej o charakterystycznym żółtym zabarwieniu:
b) utleniania dinitropochodnej L-DOPA do nitrochinonu w obecności jonów wodorotlenowych:
Celem ćwiczenia jest zapoznanie się z enzymatyczną metodą produkcji L-DOPA z wykorzystaniem tyrozynazy uzyskanej z pieczarki dwuzarodnikowej (Agaricus Bisporus).
Odczynniki i sprzęt:
1. 200 g świeżych pieczarek, mrożonych w temperaturze ok. -20OC przez 12 godzin
2. Lejek Büchnera o średnicy około 20 cm oraz krążek bibuły filtracyjnej dopasowany rozmiarem do lejka
3. Homogenizator
4. Wirówka
5. Spektrofotometr UV-VIS
6. Kuwety
7. 1000 mL Acetonu schłodzonego do temperatury około -20OC
8. 1500 mL 0,1 M buforu sodowo fosforanowego o pH 7,0 schłodzonego do temperatury około +4OC
9. 80 mL Mieszaniny reakcyjnej do oznaczania aktywności tyrozynazy zawierającej: 0,1 M bufor sodowo fosforanowy pH 7,0, 7,5 mM askorbinianu sodu, 2,5 mM L-tyrozyny
10. 35 mL 2 M NaOH
11. 30 mL 2 M HCl
12. 20 mL 15 % (w/v) Roztworu molibdenianu (II) sodu zmieszanego z 20 mL 15 % (w/v) roztworu azotanu (III) sodu (NaNO2)
13. 10 mM Roztwór wzorcowy L-DOPA. Naważkę L-DOPA odważyć bardzo dokładnie. Tuż przed użyciem, rozpuścić w 5 mL ogrzanej do temperatury około 60 ºC mieszaninie reakcyjnej do oznaczania aktywności tyrozynazy.
Wykonanie doświadczenia:
Otrzymywanie enzymu z pieczarki dwuzarodnikowej
Pokroić 250 g pieczarek na drobne kawałki i umieścić w zamrażalniku lodówki na czas 12 godzin.
Ekstrakcja białek acetonem
Wszystkie następne czynności wykonywać w temperaturze 2–4OC (w łaźni lodowej). Pokrojone i mrożone pieczarki umieścić w homogenizatorze, a następnie dodać 300 mL acetonu schłodzonego do temperatury około -20OC. Uzyskany homogenat przesączyć przez bibułę filtracyjną umieszczoną w lejku Büchnera. Osiadły na bibule osad zebrać i przenieść ponownie do homogenizatora dodając kolejną porcję 300 mL schłodzonego acetonu i homogenizować, a następnie powstały homogenat przesączyć na lejku Büchnera. Osad zebrać z bibuły i umieścić w homogenizatorze i dodać 220 mL 30% (v/v) roztworu acetonu w schłodzonej, destylowanej wodzie.
Homogenizować 2 minuty, a następnie homogenat przenieść do próbówek wirówkowych. Wszystkie próbówki zrównoważyć i wirować przez 25 minut przy 6000 RPM. Z próbówek pobrać do cylindra miarowego otrzymany supernatant, zanotować objętość i przelać do zlewki o odpowiedniej objętości. Następnie dodać, ciągle mieszając, 1,5 objętości acetonu schłodzonego do temperatury około -20OC i umieścić tak sporządzony roztwór w zamrażalce do czasu utworzenia się wyraźnego osadu (40 minut). Powstałą zawiesinę białka odwirować. Supernatant odrzucić, a osad rozpuścić w 18 mL 0,1 M buforu sodowo fosforanowego (pH 7,0) schłodzonego do temperatury około +4OC .
Oznaczanie aktywności tyrozynazy – poprzez pomiar syntezy L-DOPA
Wyznaczanie krzywej wzorcowej do oznaczeń L-DOPA
Do 7 jednorazowych, plastikowych i ponumerowanych próbówek odmierzyć następujące ilości roztworów (w µL):
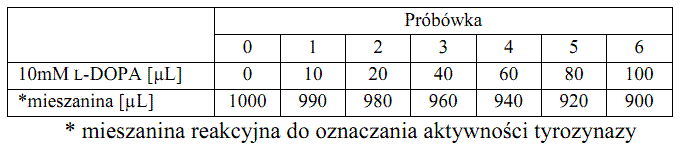
Przy użyciu pipety automatycznej dodać do każdej próbówki po: 500 µL 2 M HCl oraz 1000 µL mieszaniny 15% molibdenianu sodu z 15% azotanem (III) sodu. Następnie zawartość próbówek zmieszać używając vortexu, dodać po 1000 µL 2 M NaOH i ponownie zamieszać. Po 5 minutach zmierzyć wartość absorbancji przy λ = 460 nm względem próby odniesienia (próbówka „0”). Na podstawie uzyskanych wyników wykreślić krzywą wzorcową, odkładając na osi rzędnych wartość absorpcji (A), a na osi odciętych zawartość L-DOPA w próbie (w µmol).
Oznaczanie aktywności tyrozynazy
Do zlewki o objętości 100 mL dodać 15 mL mieszaniny reakcyjnej do oznaczania aktywności tyrozynazy. W zlewce umieścić mieszadełko magnetyczne, zapewnić regularne i jak najwolniejsze jego obroty. Następnie dodać 10 mL ekstraktu z etapu A. Przygotować zestaw 6 próbówek wg poniższego schematu i odpipetować do każdej próbówki po 500 µL 2 M HCl. Reakcję rozpoczyna się dodając preparaty enzymatyczne:

W celu oznaczenia syntezy L-DOPA pobierać co 5 minut po 1000 µL próby ze zlewki i przenosić do uprzednio przygotowanych próbówek zawierających 2 M HCl. Po zakończeniu reakcji dodać po 1000 µL mieszaniny 15% molibdenianu amonu z 15% azotanem (III) sodu. Zawartość próbówek dokładnie wymieszać i do każdej dodać po 1000 µL 2 M NaOH i ponownie zamieszać. Po 5 minutach zmierzyć wartość absorbancji przy λ = 460 nm względem odpowiedniej próby pobranej w czasie „0”.
Na podstawie uzyskanych wyników narysować wykres zależności aktywności enzymu w czasie. Ponadto sprawozdanie powinno zawierać opis funkcji i mechanizmu działania enzymów oksydacyjnych (oksydaz) w organizmach żywych, ilustrowany odpowiednimi przykładami reakcji.

