PRZEDRUK, oryginał dostępny pod adresem www
Instrukcja do ćwiczeń laboratoryjnych
Właściwości kwasowo-zasadowe związków organicznych;
Badanie rozpuszczalności związków,
dla kierunku Biotechnologia
Politechnika Śląska (www)
Wydział Chemiczny (www)
Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii (www)
Kierownik Katedry: dr hab. inż. Mirosław Gibas prof. Politechniki Śląskiej
Adres:
ul. B. Krzywoustego 4
44-100 Gliwice
Ustalenie rozpuszczalności związku organicznego w wybranych rozpuszczalnikach dostarcza wstępnych informacji na temat charakteru badanego związku, ponieważ rozpuszczalność jest ściśle powiązana z budową i obecnością określonych grup funkcyjnych. Wstępne testy na rozpuszczalność pozwalają uzyskać informacje o kwasowym, zasadowym lub obojętnym charakterze badanego związku. Stanowią one podstawę do zaliczenia związku organicznego do odpowiedniej grupy rozpuszczalności, w obrębie której przeprowadzić można dalsze testy z wykorzystaniem reakcji charakterystycznych dla poszczególnych grup funkcyjnych.
Do przeprowadzenia prób rozpuszczalności stosuje się następujące rozpuszczalniki, podane w kolejności ich użycia:
– woda
– eter dietylowym
– 5% wodny roztwór NaOH
– 5% wodny roztwór NaHCO3
– 5% wodny roztwór HCl
– stężony kwas siarkowy
– 85% kwas fosforowy
Zastosowanie tak wybranych rozpuszczalników ma swoje logiczne uzasadnienie. Woda ze względu na swą polarność jest dobrym rozpuszczalnikiem związków o wyraźnie polarnym charakterze cząsteczek, w których udział części niepolarnej (najczęściej węglowodorowej) nie jest duży. Zła rozpuszczalność związku w eterze świadczy o jego silnej polarności.
Po przeprowadzeniu testu rozpuszczalności w wodzie i eterze sprawdzenie rozpuszczalności w wodnych roztworach HCl i NaOH pozwala ustalić, czy badana substancja jest lepiej rozpuszczalna w wodnych roztworach kwasu lub zasady, a tym samym, czy zawiera grupy funkcyjne kwasowe lub zasadowe (Tabela 3).
Zastosowanie silnego kwasu, jakim jest stężony kwas siarkowy, daje możliwość rozróżnienia związków będących słabymi zasadami (np. alkohole, etery) bądź ulegającymi w warunkach przeprowadzonego testu reakcjom chemicznym od związków nie ulegających w tych warunkach proponowaniu i innym widocznym przemianom (węglowodory alifatyczne).
Proces rozpuszczania w stężonym kwasie siarkowym może być procesem złożonym. Zewnętrznym przejawem takiej reakcji może być rozgrzewanie się roztworu, wydzielanie gazów, ściemnienie, zesmolenie próbki.
Dla oceny rozpuszczalności przyjmuje się umownie proporcję pomiędzy substancją rozpuszczoną a rozpuszczalnikiem. Uznaje się, że związek jest rozpuszczalny w danym rozpuszczalniku wtedy, gdy tworzy z nim homogeniczną ciecz. Wynik testu jest także pozytywny, jeżeli badana substancja ulega przemianie w rozpuszczalniku (dotyczy to zwłaszcza stosowania stężonego kwasu siarkowego) do produktów o odmiennych własnościach niż związek wyjściowy.
1. Wykonanie prób rozpuszczalności
Do przeprowadzenia prób rozpuszczalności przyjmuje się umownie następujące proporcje: 0,1 g substancji stałej (sproszkowanej) lub 0,2 cm3 cieczy oraz 3 cm3 rozpuszczalnika. Jeżeli badany związek jest ciałem stałym należy go dokładnie rozdrobnić np. w moździerzu. W przypadku cieczy próbkę odmierza się za pomocą pipety lub kalibrowanego wkraplacza. Próbki umieszcza się w małych probówkach. Dodaje się odpowiedniego rozpuszczalnika i po zatkaniu probówki korkiem wstrząsa i obserwuje efekt.
2. Podział związków organicznych na grupy rozpuszczalności
W tabeli 1 podano ogólny podział związków na grupy, w zależności od efektu rozpuszczenia w podanych rozpuszczalnikach.
Tabela 1. Podział związków organicznych na grupy rozpuszczalności
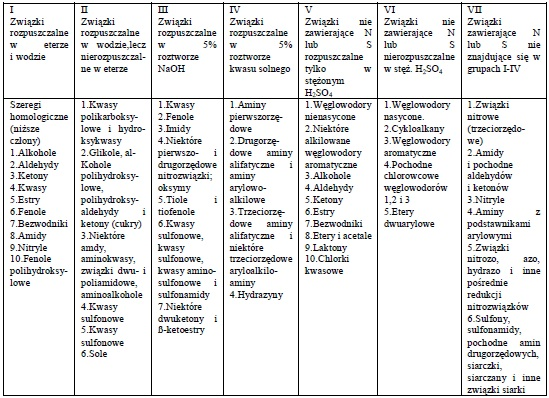
Kolejność wykonania prób podano w tabeli 2. Próby wykonuje się w kolejności od lewej kolumny (woda) do prawej (H3PO4).
Tabela 2. Kolejność wykonywania prób dla ustalenia przynależności do grup rozpuszczalności
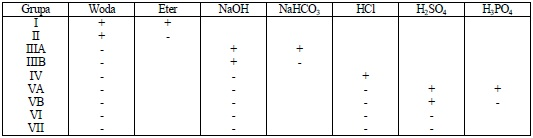
Efekt pozytywny (+) pozwala na zakwalifikowanie związku do danej grupy rozpuszczalności i dalsze przeprowadzenie testów na grupy funkcyjne. Niekiedy użyteczne jest sprawdzenie innych rozpuszczalników, zwłaszcza dla pierwszych czterech grup rozpuszczalności. Przykładowo stwierdzenie wydzielania się CO2 w reakcji z NaHCO3 dla związku zaliczonego do pierwszej grupy rozpuszczalności świadczyć może o obecności grupy karboksylowej; związek zaliczony do grupy trzeciej może zawierać także grupy aminowe i rozpuszczać się w 5% roztworze HCl.
3. Próba rozpuszczalności w wodzie i eterze
Wykonanie próby:
Do 0,1 g substancji stałej i 0,2 cm3 cieczy umieszczonej w probówce dodaje się 3 cm3 wody (eteru) porcjami po 1 cm3, za każdym razem wstrząsając zawartość probówki i obserwując efekt. Należy zbadać pH roztworu wodnego.
Omówienie:
3.1. GRUPA I – Związki rozpuszczalne w wodzie i eterze
Woda jest rozpuszczalnikiem polarnym i będą się w niej rozpuszczać związki zawierające polarne grupy funkcyjne i stosunkowo krótkie hydrofobowe fragmenty (łańcuchy węglowodorowe), przy czym wpływ części polarnej i niepolarnej jest stosunkowo wyrównany.
Jeżeli związek jest rozpuszczalny w wodzie i eterze to można sądzić, że:
a) jest to związek niejonowy lub jonizuje w niewielkim stopniu
b) posiada do pięciu atomów węgla w cząsteczce
c) zawiera polarna grupę, zdolna do tworzenia wiązań wodorowych
d) zawiera nie więcej niż jedną grupę polarną
Do związków takich zalicza się zawierające do pięciu atomów w cząsteczce:
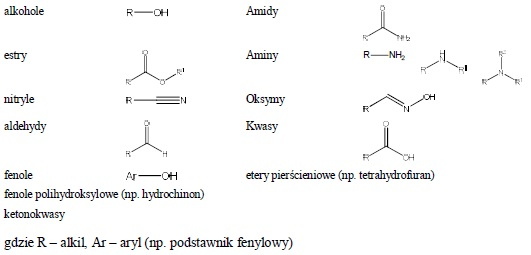
Umownie przyjęta proporcja wody (eteru) i badanej próbki decyduje niejednokrotnie o przynależności związku do pierwszej lub dalszych grup rozpuszczalności, a granica podziału nie jest ostra. Często związki tego samego szeregu homologicznego zawierające przecież te same grupy funkcyjne są klasyfikowane do różnych grup. 3.2. GRUPA II – Związki rozpuszczalne w wodzie, a nierozpuszczalne w eterze
Należą do nich związki o przeważającym wpływie polarnej części cząsteczki, co, sprzyjając rozpuszczaniu w wodzie, ogranicza rozpuszczalność w eterze. Mogą to być:
a) związki jonowe (sole)
b) związki zawierające więcej niż jedną grupę polarną, przy czym na każdą grupę polarną wypada nie więcej niż cztery atomy węgla
Z reguły nierozpuszczalne w eterze są związki zawierające niżej wymienione grupy funkcyjne:
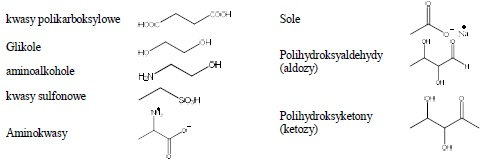
4. Próba rozpuszczalności w roztworze 5% NaOH i NaHCO3
Wykonanie próby:
Do probówki wprowadza się 0,1 g badanej substancji stałej lub 0,2 cm3 cieczy i dodaje stopniowo 3 cm3 roztworu NaOH. Jeżeli substancja nie uległa rozpuszczeniu przenosi się za pomocą pipetki część warstwy wodnej do innej probówki i stopniowo dodaje 5% HCl, aż do odczynu kwaśnego. Powstanie osadu lub zmętnienie świadczy o obecności związku o charakterze kwasowym.
Podobnie przeprowadza się test na rozpuszczalność w roztworze NaHCO3. W tym wypadku należy zwracać szczególną uwagę na wydzielanie się pęcherzyków CO2.
Omówienie:
4.1. GRUPA III – Związki nierozpuszczalne w wodzie, lecz rozpuszczalne w 5% roztworze NaOH
Do tej grupy należą związki, które posiadają wystarczająco silny charakter kwasowy, by ulec reakcji z wodnym roztworem NaOH (patrz Tabela 3.)
Część związków rozpuszcza się także w 5% roztworze NaHCO3; poniżej wymieniono typy związków należące do tej grupy, z podziałem na dwie części: grupę IIIA i IIIB. Pouczające jest porównanie w tabeli 3 stałych pKa dla kwasów karboksylowych (4-5), kwasu węglowego (6,35), fenoli (9-11) i wody (16). Z tych danych oraz reguły, że każdy kwas reagować będzie z zasadą, która jest w tabeli uszeregowana niżej (wyższa wartość pKa) wynika, iż reakcja:
będzie przesunięta w prawo (z wydzieleniem CO2), natomiast reakcja:
nie jest obserwowana.
4.1.1. GRUPA IIIA – Związki rozpuszczalne w roztworze NaOH i NaHCO3
Należą do nich:
– kwasy karboksylowe
– kwasy sulfinowe (ArSO2H)
– kwasy sulfonowe (ArSO3H)
– fenole z grupami elektronoakceptorowymi (2,4-dinitrofenol, 2,4,6-trinitrofenol, 2,4,6-tribromofenol).
4.1.2. GRUPA IIIB – Związki rozpuszczalne w roztworze NaOH i nierozpuszczalne w roztworze NaHCO3
Do grupy tej należą związki, dla których wartość pKa jest wyższa niż kwasu węglowego, a niższa niż wody. Przykłady związków podano poniżej:
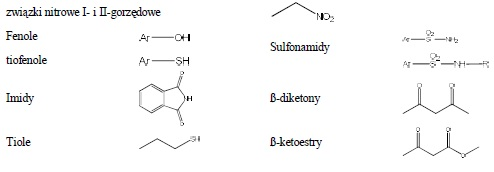
5. Próba rozpuszczalności w 5% roztworze HCl
Wykonanie próby:
Do 0,1 g stałej substancji lub 0,2 cm3 cieczy dodaje się porcjami 3 cm3 kwasu. Niektóre zasady organiczne tworzą chlorowodorki rozpuszczalne w wodzie, lecz wytrącające się wobec nadmiaru kwasu. Rozpuszczenie badanej próbki w którymkolwiek momencie świadczy o pozytywnym wyniku testu. Jeżeli próbka nie uległa całkowitemu rozpuszczeniu należy pipetką pobrać część wodnego roztworu do innej probówki i powoli neutralizować 5% wodnym roztworem NaOH. Wydzielenie osadu lub emulsji świadczy o pozytywnym wyniku testu.
Omówienie:
GRUPA IV – Związki rozpuszczalne w 5% roztworze HCl
Większość związków rozpuszczalnych w roztworze HCl zawiera w cząsteczce zasadowy atom azotu (atom posiadający wolną parę elektronową). Są to aminy alifatyczne wszystkich rzędów, pierwszorzędowe aminy aromatyczne (grupy arylowe zmniejszają zasadowość azotu), aminy alifatyczno-aromatyczne, aminy alicykliczne. Niektóre związki zawierające tlen (piron) mogą tworzyć już z 5% roztworem kwasu solnego sole oksoniowe i są w nim rozpuszczalne. Nierozpuszczalne w wodzie amidy niepodstawionej i jednopodstawione są także nierozpuszczalne. Natomiast niektóre amidy dwupodstawione mogą ulegać rozpuszczeniu.
Niżej wymieniono niektóre typy związków:

Niektóre związki zawierające grupy aminowe nie ulegają rozpuszczeniu w roztworze HCl, z uwagi na tworzenie wewnętrznych soli. Przykładem jest kwas p-aminobenzenosulfonowy:
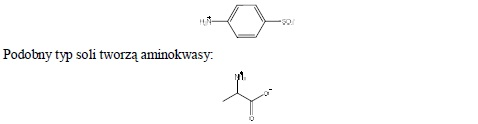
jednakże osłabienie zasadowego charakteru grupy aminowej jest w tym przypadku mniejsze (aminokwasy rozpuszczają się w roztworze HCl).
6. Próbka rozpuszczalności w stężonym kwasie siarkowym i 85% kwasie fosforowym
Wykonanie próby:
W suchej probówce umieszcza się 3 cm3 czystego stężonego kwasu siarkowego i dodaje 0,1 g substancji stałej lub 0,2 cm3 cieczy. Jeżeli związek nie rozpuszcza się natychmiast należy delikatnie wstrząsać probówką, obserwując uważnie, czy nie zachodzi zmiana barwy próbki, zesmolenie, wydzielanie produktów gazowych. Należy wyraźnie rozróżnić nierozpuszczalność produktu reakcji od rozpuszczalności badanego związku. Dlatego reakcja badanego związku z kwasem siarkowym nawet połączona z wytrąceniem osadu jest podstawą do uznania związku za rozpuszczalny.
Podobnie wykonuje się próbę rozpuszczalności w kwasie fosforowym, jedynie przy pozytywnym wyniku rozpuszczenia w stężonym H2SO4.
Omówienie:
6.1. GRUPA V – Związki nie zawierające azotu i siarki, nierozpuszczalne w wodzie oraz poszczególnych kwasach alkaliach, rozpuszczalne w kwasie siarkowym
Liczną grupą związków należących do V grupy rozpuszczalności są związki zawierające tlen. Ich rozpuszczalność spowodowana jest zasadowym charakterem atomów tlenu, mogących tworzyć jony oksoniowe.
Często rozcieńczenie rozpuszczonej próbki przez ostrożne wprowadzenie jej do wody powoduje wydzielanie związku w postaci niezmienionej. W wielu wypadkach jony oksoniowe mogą jednak ulegać dalszym przemianom.
Do V grupy rozpuszczalności należą także węglowodory nienasycone, ulegające rozpuszczeniu wskutek tworzenia wodorosiarczanów alkilowych oraz węglowodory polialkiloaromatyczne i etery alkilowo-arylowe, ulegające sulfonowaniu. Do V grupy rozpuszczalności należy najwięcej klas związków, z tego względu korzystne jest wykonanie dodatkowego badania rozpuszczalności w 85% kwasie fosforowym.
W kwasie fosforowym rozpuszczają się:
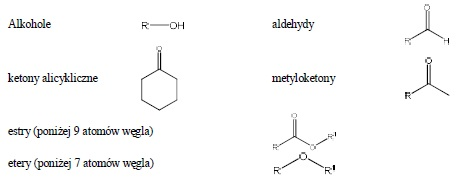
Ponadto do V grupy rozpuszczalności należą związki rozpuszczalne wyłącznie w stężonym kwasie siarkowym:
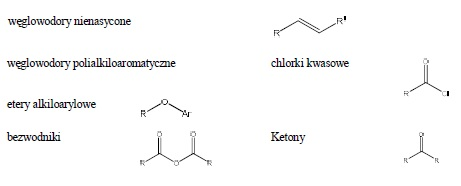
6.2. GRUPA VI – Związki nie zawierające azotu i siarki , nie odpowiadające warunkom rozpuszczalności dla grup I-V
Do tej grupy zalicza się:
– węglowodory nasycone (oktan, cykloheksan)
– węglowodory aromatyczne (toluen, naftalen)
– chlorowcopochodne węglowodorów (bromobenzen, 1-chlorobutan)
– etery diarylowe (eter difenylowy)
6.3. GRUPA VII – Związki zawierające azot lub siarkę, nie odpowiadające warunkom rozpuszczalności grup I-V
Klasy związków zostały wymienione w tabeli 1. Do grupy tej należy szereg związków, w których występujące atomy azotu lub siarki nie posiadają lub posiadają znacznie ograniczone właściwości zasadowe.

