PRZEDRUK, oryginał dostępny pod adresem www
Tytuł oryginalny: Materiały dodatkowe – pochodne kwasu węglowego,nitryle i izocyjanki
Autor: dr Marek Żylewski
Uniwersytet Jagielloński (www)
Wydział Farmaceutyczny Collegium Medicum (www)
Katedra Chemii Organicznej (www)
Kierownik: Prof. UJ, dr hab. Marek Cegła
Adres:
ul. Medyczna 9
30-688 Kraków
Kontakt: tel. 012 620 55 00
1. Własności chemiczne fosgenu
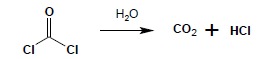
Najprostszą, trwałą pochodną kwasu węglowego (który sam jest związkiem nietrwałym, nieznanym w stanie wolnym), o dość szerokim wykorzystaniu w chemii organicznej jest fosgen – czyli dichlorek kwasu węglowego (nazwa systematyczna – dichlorek karbonylu). Otrzymuje się go w wyniku reakcji pomiędzy tlenkiem węgla(II) i chlorem: CO + Cl2 -> COCl2. Jest silnie trującym gazem, ulegającym, podobnie do innych chlorków kwasowych, wielu reakcjom, w których może ulegać wymianie jeden bądź oba atomy chloru. Pod wpływem wody fosgen ulega szybkiej hydrolizie:
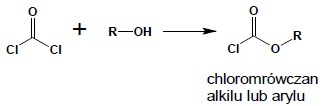
Reakcja z alkoholami biegnie w kierunku powstawania odpowiednich estrów w zależności od użytych proporcji substratów. Używając stechiometrycznych ilości alkoholu, otrzymuje się estry nieistniejącego w stanie wolnym kwasu chloromrówkowego:
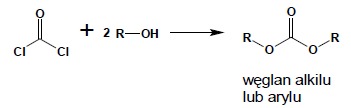
Działając nadmiarem alkoholu otrzymać można estry kwasu węglowego:
W reakcji z amoniakiem powstaje diamid kwasu węglowego – mocznik:
![]()
Podobnie w reakcji z nadmiarem amin pierwszo- czy drugorzędowych powstają symetrycznie N-podstawione pochodne mocznika:
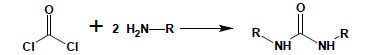
I-rzędowe aminy reagując w stosunku 1:1 z fosgenem dają izocyjaniany. Reakcja jest procesem dwuetapowym – w pierwszym etapie powstają nietrwałe amidy kwasu chlorowęglowego, które samorzutnie tracąc cząsteczkę chlorowodoru, przekształcają się w izocyjaniany:
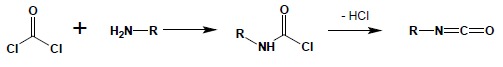
Powyższa reakcja jest najdogodniejszą metodą syntezy tych połączeń.
Wszystkie przedstawione powyżej reakcje można również przeprowadzić dla siarkowego analogu dichlorku karbonylu – tiofosgenu, otrzymywanego w reakcji disiarczku węgla z chlorem:
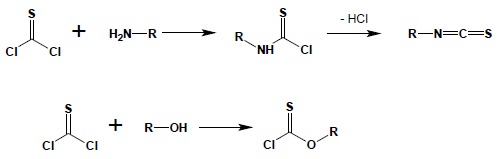
2. Mocznik
Diamid kwasu węglowego jest krystalicznym ciałem stałym, Otrzymuje się go (i jego alkilowe czy arylowe pochodne) zgodnie z reakcjami podanymi w punkcie 1. Ogrzewany traci cząsteczkę amoniaku, dając biuret, którego dalsze ogrzewanie pozwala na otrzymanie kwasu cyjanurowego:
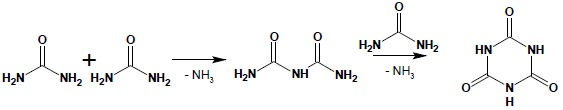
Mocznik ulegać może również reakcji z chlorkami kwasowymi dając odpowiednie pochodne acylowe:
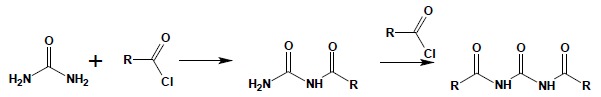
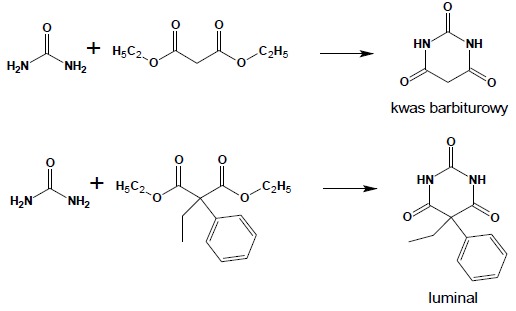
Acylowe pochodne mocznika noszą zwyczajową nazwę: ureidy. Do bardzo ważnych cyklicznych ureidów należą pochodne kwasu barbiturowego, otrzymywane w reakcji mocznika z odpowiednio podstawionymi, reaktywnymi pochodnymi kwasu malonowego (najczęściej używane są estry).
Pochodne kwasu barbiturowego, jak i ich siarkowe analogi, otrzymywane z tiomocznika należą do ważnej grupy leków szeroko stosowanych jako środki uspokajające czy nasenne.
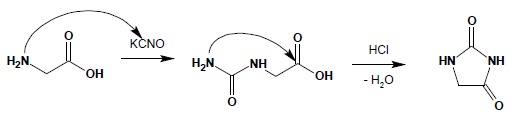
Innym bardzo ważnym ureidem cyklicznym jest hydantoina. Otrzymać ją można działając na glicynę (kwas aminooctowy) cyjanianem potasu:
3. Izocyjaniany, izotiocyjaniany
Związki te, otrzymywane głównie z fosgenu (tiofosgenu) i amin (patrz pkt. 1), ulegają różnym reakcjom addycji do reaktywnego wiązania N=C, Reakcje te biegną zgodnie z rozkładem ładunku w grupie izocyjanianowej, wynikającym z elektroujemności atomów. Najistotniejsze są reakcje z wodą (hydroliza), alkoholami i aminami. Hydroliza prowadzi do otrzymania amin pierwszorzędowych. Produktem pośrednim w tej reakcji jest kwas karbamowy, ulegający samorzutnemu rozpadowi:
![]()
Reakcja z alkoholami czy fenolami prowadzi do otrzymania estrów kwasów karbamowych – karbaminianów, noszących zwyczajową nazwę: uretany.
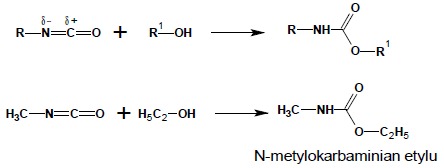
W reakcji z aminami powstają pochodne mocznika. Jest to najlepsza metoda syntezy niesymetrycznie podstawionych pochodnych mocznika:
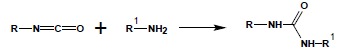
Analogicznym reakcjom ulegają siarkowe analogi izocyjanianów – izotiocyjaniany dając estry kwasu tiokarbamowego czy pochodne tiomocznika.
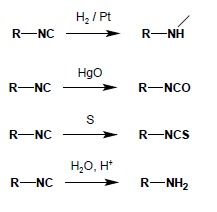
4. Nitryle i izocyjanki
Nitryle ulegają różnym reakcjom, wśród których najważniejsze są reakcje hydrolizy, redukcji oraz reakcja ze związkami Grignarda.
Reakcje hydrolizy nitryli wykonuje się, wykorzystując te związki do syntezy kwasów karboksylowych, szczególnie że pochodne te można łatwo otrzymać w wyniku substytucji nukleofilowej (nitryle alifatyczne) czy też w reakcji Sandmeyera (nitryle aromatyczne. Reakcję tą można wykonywać zarówno korzystając z katalizy kwaśnej, jak i zasadowej. Jako produkt pośredni tworzy się amid, jednakże hydrolizuje on łatwiej niż wyjściowy nitryl, dlatego też zatrzymanie reakcji na etapie amidu jest bardzo trudne:
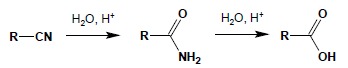
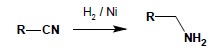
W reakcji redukcji otrzymać można aminy I-rzędowe
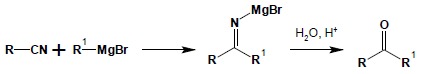
Reakcja nitryli ze związkami Grignarda stanowi dogodną metodę otrzymywania ketonów. W pierwszym etapie następuje addycja cząsteczki związku Grignarda do wiązania potrójnego grupy cyjankowej, dając w rezultacie sól tzw. ketiminy. Powstały produkt pośredni następnie można łatwo zhydrolizować do odpowiedniego ketonu:
Izocyjanki są bardzo reaktywnymi pochodnymi, ze względu na występowanie w nich dwuwartościowego atomu węgla. Otrzymać je można np. w reakcji izocyjankowej amin pierwszorzędowych z chloroformem i zasadą sodową (reakcja ta jest wykorzystywana jako próba analityczna, pozwalająca wykryć I-rzędową grupę aminową – powstający izocyjanek jest związkiem lotnym o bardzo nieprzyjemnym, duszącym, charakterystycznym zapachu):
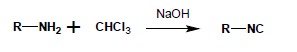
Częściej stosowaną metodą syntezy izocyjanków jest odwadnianie odpowiednich Npodstawionych pochodnych formamidu:
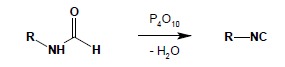
Związki te ulegają łatwo reakcjom redukcji, utleniania i hydrolizy: