PRZEDRUK, oryginał dostępny pod adresem www
Tytuł oryginalny: Oznaczanie stężenia glukozy metodą chemiczną i enzymatyczną w produktach spożywczych
Uniwersytet Gdański (www)
Wydział Chemii (www)
Katedry Chemii Bioorganicznej (www)
Kierownik: Prof. dr hab. Krzysztof Rolka
Adres:
ul. Sobieskiego 18/19
80-952 Gdańsk
Kontakt: tel. 58 52 35 386
____________________________________________________________________________
Doświadczenie pozwala na ilościowe oznaczenie i porównanie zawartości glukozy w produktach spożywczych oraz porównanie specyficznej (enzymatyczna) i niespecyficznej (chemiczna) metody oznaczania substancji (w tym przypadku glukozy).
Metoda enzymatyczna polega na:
(a) przekształceniu glukozy przez oksydazę glukozową w kwas glukonowy przy jednoczesnym utworzeniu nadtlenku wodoru:
glukoza + H2O + O2 → kwas glukonowy + H2O2
a następnie,
(b) redukcji H2O2 przez peroksydazę w obecności o-dianizydyny (DH2), która ulega utlenieniu tworząc barwny produkt końcowy (związek D):
H2O2 + DH2 → 2H2O + D
Metoda chemiczna wykorzystuje właściwości redukujące cukrów i polega na redukcji kwasu 3,5-dinitrosalicylowego (DNS) w środowisku alkalicznym i w wysokiej temperaturze do barwnego produktu. Metoda ta jest niespecyficzna, gdyż redukcja DNS będzie w tym przypadku miarą ogólnej zdolności redukcyjnej badanej próby i nie może wobec tego zostać wykorzystana do ilościowego oznaczenia glukozy w obecności innych czynników redukujących (innych cukrów redukujących, np. fruktozy, laktozy i maltozy lub innych związków o właściwościach redukujących).
Odczynniki i sprzęt laboratoryjny:
1. Pipety automatyczne (2 – 20 μL, 20 – 200 μL i 100 – 1000 μL)
2. Pipety 10 mL
3. Próbówki chemiczne
4. Cylindry 100 mL
5. Zlewki 500 mL
6. Lejki
7. Sączki
8. Łaźnia wodna (37°C)
9. Łaźnia wodna (70°C)
10. Łaźnia wrząca
11. Spektrofotometr UV-Vis
12. Woda dejonizowana
13. Roztwór 1: 85 mM K4[Fe(CN)6] × 3H2O (rozpuścić 3,6 g w 100 mL wody)
14. Roztwór 2: 250 mM ZnSO4 × 7H2O (rozpuścić 7,2 g w 100 mL wody)
15. 3 M NaOH
16. 0.4 M NaOH
17. 10 mM glukoza
18. 1% [w/v] roztwór kwasu 3,5-dinitrosalicylowego (DNS) w 0,4 M NaOH
19. Sok owocowy (jabłkowy)
20. Piwo jasne
21. Mleko skondensowane słodzone
22. Miód naturalny
Wykonanie doświadczenia:
1. Przygotowanie próbek
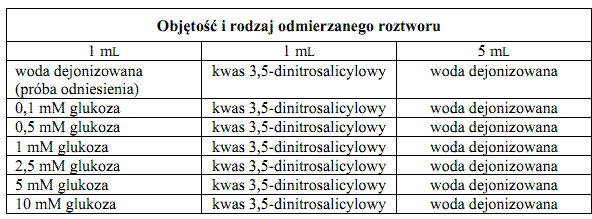
Krzywa wzorcowa: Używając 10 mM roztworu glukozy i wody dejonizowanej, przygotować po 5 mL roztworów glukozy o następujących stężeniach: 10 mM, 5 mM, 2,5 mM, 1 mM, 0,5 mM i 0,1 mM.
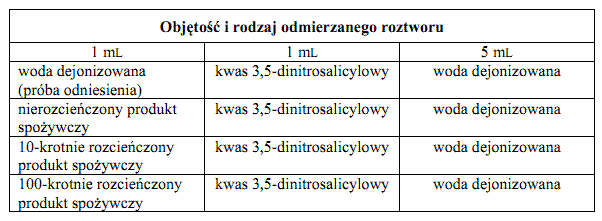
Sok owocowy (jabłkowy): Do 100 mL klarownego soku w zlewce dodać 5 mL roztworu 1 i dokładnie wymieszać, następnie dodać 5 mL roztworu 2 i ponownie wymieszać. Przy pomocy 3M NaOH doprowadzić pH mieszaniny do ok 8,0 (zanotować całkowitą użytą objętość roztworu NaOH) i przefiltrować używając lejka i sączka z bibuły. Następnie przygotować po 5 mL 10- oraz 100-krotnie rozcieńczonych próbek w wodzie dejonizowanej.
Piwo jasne: Wymieszać intensywnie w zlewce 50 mL piwa (w celu usunięcia pęcherzyków dwutlenku węgla) i przygotować po 5 mL 10-krotnie oraz 100-krotnie rozcieńczonej próbki w wodzie dejonizowanej.
Mleko skondensowane słodzone: Do 1 mL mleka dodać 60 mL wody dejonizowanej i ogrzewać przez 15 minut w temp. 70°C, często mieszając. Dodać 5 mL roztworu 1, starannie wymieszać, dodać 5 mL roztworu 2 i ponownie dokładnie wymieszać. Dodać 2,5 mL 0.4 M NaOH i wymieszać. Pozostawić w temp. pokojowej na 5 minut, zamieszać i przefiltrować używając lejka i sączka z bibuły. Przygotować 5 mL 10-krotnie oraz 100-krotnie rozcieńczonej próbki w wodzie dejonizowanej.
Miód naturalny: Ok. 10 g miodu przenieść do zlewki, ogrzewać w temp. 70°C mieszając aż do jego upłynnienia. Przenieść dokładnie 1 g płynnego miodu do nowej zlewki i rozpuścić w 100 mL dejonizowanej wody. Przygotować 5 ml 10-krotnie oraz 100-krotnie rozcieńczonej próbki w wodzie dejonizowanej.
Oznaczenie poziomu cukrów redukujących w próbach metodą chemiczną przy pomocy kwasu 3,5-dinitrosalicylowego
Do podpisanych probówek odpipetować roztwory wg poniższych tabeli, wymieszać ich zawartość i razem wstawić do wrzącej łaźni wodnej na 5 minut.
Krzywa wzorcowa:
Sok, piwo, mleko, miód
Po schłodzeniu próbówek, zmierzyć absorbancję przy długości fali 550 nm, stosując jako próbę odniesienia probówkę z samą wodą dejonizowaną. Na podstawie krzywej wzorcowej wykreślonej w oparciu o absorbancję roztworów glukozy o znanym stężeniu, obliczyć ilość materiału redukującego w badanych próbkach. Czy uzyskany wynik rzeczywiście odpowiada zawartości glukozy w badanym materiale?
Oznaczenie poziomu glukozy w próbach metodą enzymatyczną z wykorzystaniem oksydazy glukozowej i peroksydazy
Przygotować następujące odczynniki:
Odczynnik A – 50 mM bufor sodowo-octanowy pH 5,1.
Odczynnik B – 0,21 mM roztwór chlorowodorku o-dianizydyny otrzymać poprzez rozpuszczenie 50mg chlorowodorku o-dianizydyny w 7,6 mL wody dejonizowanej, a następnie pobrać 1 mL roztworu i dodać 100 mL odczynnika A (buforu sodowo-octanowego pH 5,1).
Odczynnik C – (glukoza, sok, piwo, mleko, miód)

Odczynnik D – 0,17 mM roztwór chlorowodorku o-dianizydyny z dodatkiem odczynnika C. Zmieszać 4,8 ml odczynnika B z 1 ml odczynnika C (glukoza lub badana próbka) i ogrzać do temperatury 35 °C w łaźni wodnej.
Odczynnik E (wykonać bezpośrednio przed eksperymentem!) roztwór peroksydazy rozpuścić w zimnej destylowanej wodzie, tak aby końcowe stężenie peroksydazy wynosiło 50 jednostek aktywności/mL.
Odczynnik F – przygotować roztwór oksydazy glukozowej zawierający 40 jednostek aktywności/mL, jako rozpuszczalnik stosować odczynnik A (bufor sodowo-octanowy pH 5,1). Bezpośrednio przed pomiarem odczynnik rozcieńczyć 40-krotnie odczynnikiem A, tak aby otrzymane stężenie wyniosło 1 jednostkę aktywności/mL.
Oznaczanie glukozy
W kuwecie o pojemności 1,5 mL umieścić używając pipety automatycznej 1,45 mL odczynnika D, a następnie 50 µL roztworu enzymu – peroksydazy (odczynnik E). Zawartość kuwety wymieszać. Następnie dodać 50 µL oksydazy glukozowej (odczynnika F) przygotowanego bezpośrednio przed tym etapem ćwiczenia. Po upływie 5 minut dokonać pomiaru absorbancji przy długości fali 500 nm. Wykreślić krzywą kalibracyjną i określić stężenie glukozy w badanych próbkach.
Uzyskane wyniki z punktów 2 i 3 zamieszczamy w tabeli (przykład poniżej)


