PRZEDRUK, oryginał dostępny pod adresem www
Tytuł oryginalny: Materiały dodatkowe – związki azotowe
Autor: dr Marek Żylewski
Uniwersytet Jagielloński (www)
Wydział Farmaceutyczny Collegium Medicum (www)
Katedra Chemii Organicznej (www)
Kierownik: Prof. UJ, dr hab. Marek Cegła
Adres:
ul. Medyczna 9
30-688 Kraków
Kontakt: tel. 012 620 55 00
1. Właściwości kwasowo-zasadowe tioli.
siarki analogi alkoholi i fenoli – tiole (R-SH) są związkami o znacznie większej kwasowości niż odpowiadające im pochodne tlenowe. Wszystkie tiole są kwasami znacznie silniejszymi od wody, zatem reagują z wodnymi roztworami wodorotlenków alkalicznych, dając sole: R-SH + NaOH → R-SNa + H2O. Powstające sole ulegają jedynie nieznacznej hydrolizie w roztworach wodnych. Działając na tiole jonami metali ciężkich, otrzymuje się najczęściej sole nierozpuszczalne.
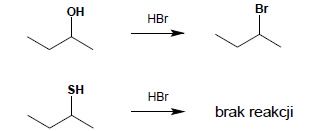
Tiole, w przeciwieństwie do alkoholi są praktycznie zupełnie pozbawione właściwości zasadowych (w przypadku alkoholi, które pod wpływem silnych kwasów mineralnych przechodzą w sole oksoniowe), co powoduje, że nie są możliwe do wykonania reakcje wymiany grupy SH na inne podstawniki. Reakcje wymiany grupy OH alkoholi na fluorowiec pod wpływem HCl (w obecności ZnCl2), HBr czy HI rozpoczynają się bowiem od utworzenia jonu oksoniowego – w związku z tym w przypadku tioli reakcja taka nie jest możliwa:
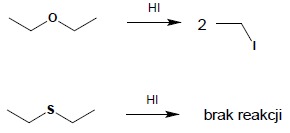
Z tej samej przyczyny sulfidy nie ulegają reakcji rozszczepienia pod wpływem HI. Również i ta reakcja rozpoczyna się w przypadku eterów od utworzenia soli oksoniowej, co jest niemożliwe do przeprowadzenia dla ich siarkowych analogów:
2. Reakcja tioli ze związkami karbonylowymi.
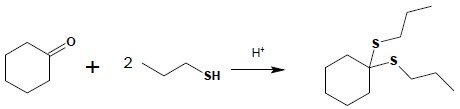
Tiole są bardzo dobrymi odczynnikami nukleofilowymi. Jedną z reakcji, w których własności te się przejawiają, jest reakcja tioli z aldehydami i ketonami. W jej wyniku otrzymuje się tiacetale lub tioketale:
3. Reakcje redoks tioli i sulfidów
Tiole ulegają łatwo reakcji utleniania. Jej wynik zależy od użytego utleniacza. Łagodne utleniacze (woda utleniona, jod) utleniają tiole do disulfidów:
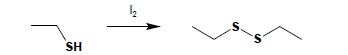
Reakcja powstawania mostków dwusiarczkowych jest bardzo istotna w układach biologicznych, w różnych reakcjach enzymatycznych i w procesach biosyntezy białek. Energiczne utlenianie (KMnO4, HNO3) prowadzi do otrzymania kwasów sulfonowych. Reakcja jest procesem wieloetapowym, jednakże nie jest możliwe zatrzymanie jej na żadnym z etapów pośrednich – związki będące produktami pośrednimi ulegają bardzo dalszemu utlenianiu.
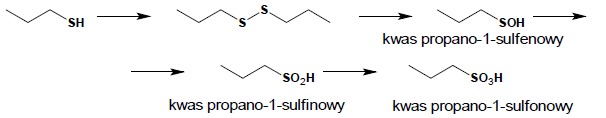
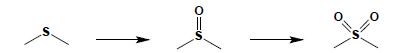
Sulfidy ulegają łatwemu utlenianiu do sulfotlenków i dalej do sulfonów:
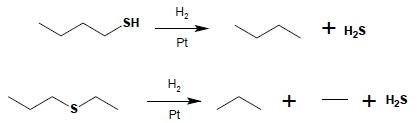
Redukcja tioli i sulfidów silnymi reduktorami lub wodorem na katalizatorze powoduje powstanie odpowiedniego węglowodoru i siarkowodoru:
4. Kwasy sulfonowe
Organiczne kwasy sulfonowe są kwasami o mocy porównywalnej z mocą kwasu siarkigo. Ulegają stosunkowo trudno reakcjom podstawienia w grupie sulfonowej – nie jest możliwa reakcja bezpośredniej estryfikacji czy otrzymywania amidów. Można natomiast otrzymać z nich chlorki kwasowe w reakcji z PCl5:
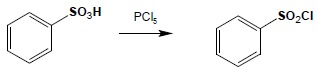
Tak otrzymane chlorki kwasowe ulegają reakcjom analogicznym do tych którym ulegają chlorki kwasów karboksylowych – można z nich otrzymywać estry, amidy czy też sulfony w reakcji Friedela-Craftsa:
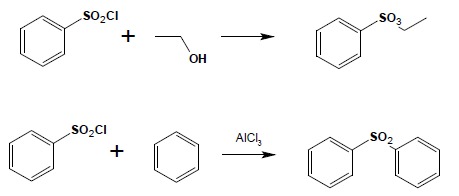
5. Otrzymywanie związków siarkoorganicznych Tiole i sulfidy alifatyczne można otrzymać w reakcji halogenopochodnych z wodorosiarczkiem lub siarczkiem sodu:
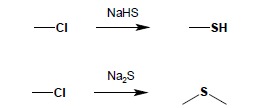
Otrzymywanie tioli tą metodą napotyka na trudności związane z dalszą reakcją tioli z halogenopochodnymi i tworzeniem sulfidów. Najlepszą metodą otrzymywania tioli alifatycznych jest reakcja halogenopochodnych z tiomocznikiem i hydroliza tak powstałych soli alkiloizotiuroniowych:
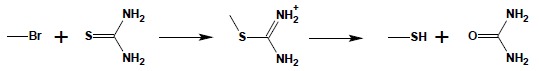
Tiole aromatyczne otrzymuje się poprzez redukcję chlorków kwasów sulfonowych:
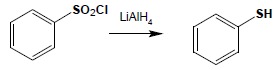
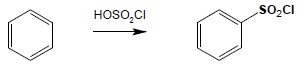
Najczęściej otrzymywane aromatyczne kwasy sulfonowe otrzymuje się poprzez bezpośrednie sulfonowanie. Często również używa się do reakcji sulfonowania kwasu chlorosulfonowego, otrzymując w ten sposób wprost chlorki kwasów sulfonowych, potrzebne do dalszych syntez: