Multipleks PCR to technika wykorzystywana w biologii molekularnej i służąca do amplifikowania wielu matryc podczas jednej reakcji PCR. Dzięki jednoczesnemu wykorzystaniu różnych zestawów primerów metoda ta zapewnia dużą oszczędność czasu oraz pozwala obniżyć koszty przeprowadzanych badań przy jednoczesnym zachowaniu wysokiej jakości uzyskiwanych wyników. Powielane sekwencje docelowe mogą być wewnętrznymi fragmentami pojedynczej matrycy. Jest to tzw. Single Template PCR Reaction. Inną odmianą jest Multiple Template PCR Reaction, w której to jedna mieszanina reakcyjna zawiera kilka matryc powielanych osobno przez odpowiednie startery.
Obecność wielu primerów może prowadzić do ich krzyżowej hybrydyzacji oraz zwiększa ryzyko błędów podczas wiązania się ich z sekwencją docelową. Bardzo ważną rolę odgrywa zatem właściwe zaprojektowanie starterów, które jest kluczowym etapem wpływającym na efektywność multipleks PCR.
Zaleca się, aby użyte w jednym badaniu primery charakteryzowały się zbliżoną kinetyką reakcji. Powinny mieć one odpowiednią długość (18-30 bp) oraz porównywalną temperaturę topnienia, która uzależniona jest od procentowej zawartości guaniny i cytozyny w łańcuchu. Typowa temperatura wynosi 55-60°C, a zawartość G/C waha się w granicach od 35 do 60%. Sekwencje z wyższą zawartością G/C charakteryzują się temperaturą 75-80°C. Akceptowane są różnice 3-5°C między primerami.
Ze względu na występowanie konkurencji pomiędzy starterami w jednej mieszaninie reakcyjnej, kluczową cechą primerów jest ich specyficzność w stosunku do amplifikowanej sekwencji docelowej. Niespecyficzna amplifikacja może zachodzić w innych, komplementarnych regionach, natomiast złe dopasowanie primerów prowadzi do obniżenia amplifikacji.
Dodatek każdej nowej pary primerów zwiększa ryzyko wystąpienia niespecyficznych połączeń. Warunki reakcji należy określić osobno dla każdego zestawu starterów, a następnie dodawać je kolejno do siebie i jeśli to konieczne zmieniać i dostosowywać wszystkie parametry.
Mieszaninę zaprojektowanych primerów powinno się także sprawdzić pod kątem możliwości tworzenia się dimerów (ang. primer dimer formation). Efekt ten można obniżyć stosując odpowiednie ilości starterów oraz przez właściwy dobór warunków reakcji. W celu zapobiegania niespecyficznym amplifikacjom można zastosować tzw. gorący start (ang. hot-start PCR), detergenty jonowe, skrócić czasu elongacji, przeprowadzać hybrydyzację w najwyższej możliwej temperaturze lub, jeśli inne metody zawiodą, należy ponownie przejrzeć sekwencje primerów.
Aby ujednolicić poziom amplifikacji należy także dobrać odpowiednie stężenia poszczególnych zestawów starterów. Jest to ważne zwłaszcza wtedy, gdy jeden produkt występuje częściej niż pozostałe. Zasada ta dotyczy również innych składników mieszaniny reakcyjnej. Podczas multipleks PCR, może wzrosnąć zapotrzebowanie na jony magnezu, dNTP i polimerazę DNA. Wydłużeniu może też ulec optymalny czas elongacji. Zależy to od rodzaju stosowanej techniki. Szereg metod zaprojektowanych do pojedynczego PCR (ang. uniplex PCR) można w ten sposób zaadoptować również do multipleks PCR. Są to między innymi:
• allele-specific PCR,
• ARMS-PCR (ang. Amflification Refractory Mutation System PCR),
• restriction site-generating PCR,
• color complementation assay,
• nested PCR.
Planując multipleks PCR trzeba zachować szczególną ostrożność podczas określania amplifikowanych fragmentów. Miejsca te mogą być dobrane ze względu na rodzaj przeprowadzanej analizy, np. eksony przy badaniu delecji, polimorficzne markery w badaniach kryminalistycznych oraz sekwencje specyficzne dla danego szczepu lub gatunku podczas analiz mikrobiologicznych. Należy również zaprojektować wewnętrzne fragmenty kontrolne. Mogą to być zewnętrzne sekwencje, inne eksony, sekwencje gospodarza lub takie, które są konserwatywne dla wszystkich docelowych struktur. Amplikony powinny różnić się między sobą długością. Wahania te nie mogą być jednak zbyt duże, gdyż może to uniemożliwić ich rozdział na pojedynczym żelu elektroforetycznym.
Niekiedy wymagane jest zastosowania dodatkowych analiz. Dotyczy to zwłaszcza badań mających na celu wykrycie punktowych mutacji lub innych małych zmian zachodzących w docelowych sekwencjach. Produkty reakcji multipleks PCR można zastosować jako matryce do następnych badań, co warunkuje wysoką specyficzność reakcji i jest wykorzystywane np. przy analizie prostych tandemowych powtórzeń (ang. Simple Tandem Repeats STRs). Można również zastosować trawienie enzymami restrykcyjnymi, hybrydyzację produktu, specjalne sondy oraz analizę SSCP (ang. single-stand conformational polymorphism). Wybór metody zależy od rodzaju zamplifikowanej sekwencji.
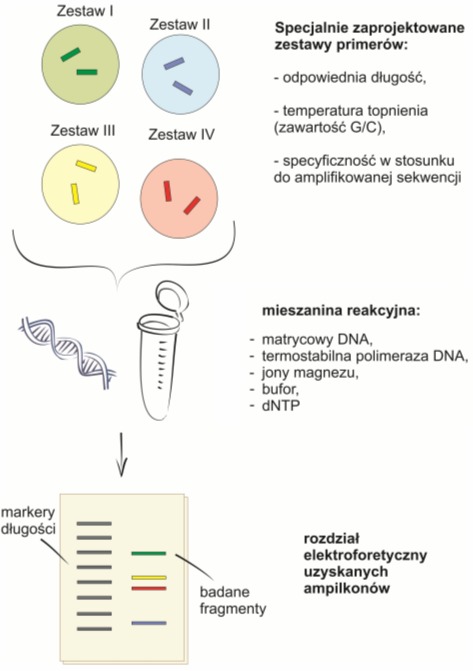
Rys. 1. Schemat obrazujący zasadę działania multipleks PCR
Zalety multipleks PCR
• system wewnętrznej kontroli
Dzięki jednoczesnej amplifikacji kilku odcinków tego samego genu, metoda multipleks PCR pozwala na przeprowadzenie wewnętrznej kontroli i wyeliminowanie ryzyka powstawania błędów (zarówno negatywnych, jak i pozytywnych fałszywych wyników). Amplikony sprawdzające, to znaczy takie, które znajdują się poza poszukiwaną sekwencją, pozwalają potwierdzić prawidłowość reakcji nawet wtedy, gdy cały badany gen uległ delecji. Przy jednoczesnej analizie kilku zbliżonych do siebie genów, np. różnych szczepów patogenów, ich analizę przeprowadza się na podstawie charakterystycznych sekwencji, próbę kontrolną stanowi zaś wspólny dla nich fragment.
• kontrola jakości matrycy
Metoda multipleks pozwala na o wiele efektywniejsze sprawdzenie jakości powielanej sekwencji docelowej. Zdegradowane próbki dają silniejszy sygnał dla dłuższych połączeń niż dla krótszych. Obecność inhibitorów może być natomiast wykryta dzięki obniżeniu efektywności amplifikacji sekwencji badanej oraz kontrolnej.
• ocena ilości docelowej sekwencji w badanej próbie
W celu oznaczenia ilości matrycy w badanej próbie należy uwzględnić ilość sekwencji referencyjnej, liczbę cykli oraz obniżenie teoretycznego podwajania się produktu w każdym etapie. Multipleks PCR z zastosowaniem fluorescencji pozwala na oszacowanie ilości względnej produktu na podstawie porównania intensywności sygnału z próbą referencyjną – bezpośrednio lub za pomocą krzywych standardowych. Wiarygodność badania podwyższa zastosowanie co najmniej dwóch innych fragmentów porównawczych. Podczas przeprowadzania analiz należy zwracać szczególną uwagę na dobór odpowiednich warunków. W momencie, kiedy sygnał jest wysyłany reakcja nie powinna zachodzić, gdyż może to zamaskować zmiany w intensywności amplikonu.
• wysoka wydajność
Zastosowanie multipleks PCR pozwala obniżyć koszta stosowanych odczynników oraz zaoszczędzić wiele czasu potrzebnego na osobne wykonanie wszystkich prób. Jest to metoda obniżająca zużycie kosztownej polimerazy, idealna w przypadku niewielkiej ilości sekwencji docelowych, tzn. w przypadku gdy dysponuje się jedynie bardzo małą próbą materiału do badań. Dla maksymalnej oszczędności czasu preparacji, próby mogą być wykonywane hurtowo i losowo sprawdzane pod względem jakości, a następnie zamrażane i przechowywane aż do czasu kiedy zostaną użyte.
Zastosowanie Multipleks PCR
• wykrywanie delecji i innych zmian w sekwencji docelowej
Mutacje te mogą być wykrywane bezpośrednio podczas reakcji PCR lub w wyniku dalszych badań nad jej produktem, np. analiza za pomocą enzymów restrykcyjnych, SSCP i in.
• Polymorphic Repetitive DNA (polimorficzne powtarzalne sekwencje DNA)
Multipleks PCR to idealna technika do profilowania DNA, czyli identyfikacji poszczególnych osobników. Krótkie tandemowe powtórzenia (STR ang. Short Tandem Repeats) lub inaczej sekwencje mikrosatelitarne bardzo dobrze nadają się do techniki multipleks, ze względu na swoje liczne występowanie oraz wysoki polimorfizm. Stosuje się je m.in. przy wykrywaniu chorób, mapowaniu genów oraz w analizach kryminalistycznych. Prawdopodobieństwo wystąpienia dwóch takich samych alleli u różnych osobników zmniejsza się wraz z rosnącą liczbą sprawdzonych polimorficznych loci.
• wykrywanie i charakteryzacja mikroorganizmów grzybów, bakterii , wirusów oraz pasożytów.
Zobacz również:
PCR
RT-PCR
Real-time PCR
Nested PCR
MLPA PCR
Autor: Anna Kurcek
Literatura:
• Mary C. Edwards, Richard A. Gibbs “Multipleks PCR:Advantages, Development and Applications”; Genome Res. 1994 (3); str. 65-75;
• Elfath M. Elnifro, Ahmed M. Ashshi, Robert J. Cooper, Paul E. Klapper “Multipleks PCR: Optimization and Application in Diagnostic Virology”; Clinical Microbiology Reviewe, Oct 2000, str. 559-570;
• www.premierbiosoft.com;

