Enzymy restrykcyjne (restryktazy, endonukleazy restrykcyjne, enzymy trawienne) są białkami o aktywności enzymatycznej, które wyizolowano z bakterii. Endonukleazy restrykcyjne rozpoznają i przecinają specyficzne sekwencje w dwuniciowej cząsteczce DNA, w rezultacie czego otrzymuje się tzw. tępe i lepkie końce.
Enzymy restrykcyjne – izoschizomery
Izoschizomery są enzymami restrykcyjnymi, rozpoznającymi tę samą sekwencję DNA. Przyjmuje się, że pierwszy zidentyfikowany enzym restrykcyjny jest prototypem rodziny, a każdy kolejny jest jego izoschizomerem. Do izoschizomerów zaliczyć można wiele przykładów enzymów. Izoschizomerem enzymu AanI jest enzym restrykcyjny PsiI. Oba rozpoznają i tną sekwencję 5′-TTA/TAA-3′. Izoschizomery izolowane są zazwyczaj z różnych szczepów bakterii, w związku z czym mogą wymagać różnych warunków reakcji, różnych temperatur, stężenia soli czy czasu reakcji.
Enzymy restrykcyjne – neoschizomery
Poza izoschizomerami w przyrodzie występują także neoschizomery. O ile izoschizomery rozpoznają i tną daną sekwencję w identycznym miejscu, to w przypadku neoschizomerów jest trochę inaczej. Neoschizomer rozpoznaje tę sama sekwencję co tzw. prototyp (enzym restrykcyjny o określonych parametrach cięcia, wyizolowany jako pierwszy), jednak tnie ją w różnych miejscach. Neoschizomery zaliczane są do specyficznego podtypu izoschizomerów.
Na przykład enzym AatII rozpoznaje i przecina sekwencje w następującym miejscu GACGT/C), przy czym jego neoschizomer ZraI rozpoznaje również tę samą sekwencję, jednak miejsce cięcia jest inne – GAC/GTC).
Badania DNA z wykorzystaniem enzymów restrykcyjnych
DNA lub produkt PCR trawimy enzymami, zwanymi endonukleazami restrykcyjnymi. Większość reakcji trawienia restryktazami przebiega nie dłużej niż 16 godzin. Obecnie, firmy oferują coraz szerszą gamę enzymów z tzw. grupy FastDigest. Trawienie zmodyfikowanymi enzymami FastDigest trwa zaledwie kilka, do kilkunastu minut (5-20 minut). Temperatura reakcji zależy od wybranego enzymu, a jej zakres może być bardzo szeroki, tj. od 37 stopni Celsjusza (np. AlwNI), do nawet 60-65 st. Celsjusza (np. BsiHKAI).
Trawienie restryktazami – zasady
– trawienie restryktazami przeprowadza się zwykle przy stężeniu 0.05-0.5µg DNA /µl;
– duża grupa enzymów restrykcyjnych, stosowanych w laboratorium, działa w jednym z trzech buforów, różniących się stężeniem soli (Tabela 1). Dane odnośnie wymaganych warunków reakcji, w tym stężenia soli, zawierają katalogi firm produkujących enzymy. Wskazane jest stosowanie buforów dostarczanych i zalecanych przez producenta danego enzymu;
– używane do trawienia bufory przygotowuje się w postaci stężonych roztworów (zazwyczaj x10);
– najczęściej używane bufory do enzymów restrykcyjnych to:
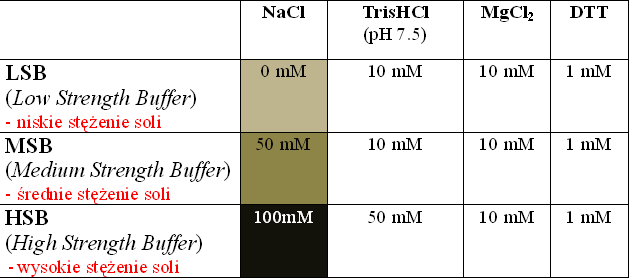
– jeśli zamierzamy trawić DNA (lub produkt reakcji PCR) dwoma enzymami, wymagającymi różnych buforów, należy najpierw przeprowadzić trawienie w buforze o niższym stężeniu soli, a następnie w buforze o wyższym stężeniu soli;
– ilość enzymu, jaką należy użyć w reakcji, oblicza się w oparciu o następującą definicję: 1 jednostka enzymu trawi kompletnie 1 µg DNA faga λ (ok. 50 kb), w czasie 1 godziny;
– ze względu na obecny w preparatach enzymatycznych glicerol, nie należy dodawać więcej enzymu niż 1/10 objętości mieszaniny reakcyjnej. Glicerol może hamować aktywność enzymu lub wpływać na jego specyficzność;
– niektóre enzymy, w pewnych warunkach reakcji trawienia, posiadają aktywność określaną jako aktywność „star”. Jest to własność enzymów restrykcyjnych, polegająca na obniżeniu lub zaniku specyficzności ich działania. W wyniku zaniku specyficzności, cięcie DNA następuje w miejscach innych niż restrykcyjne. Wraz ze spadkiem specyficzności, cięciu podlegają miejsca coraz bardziej różne od oryginalnej sekwencji restrykcyjnej. Informacje o aktywności „star” podawane są przez producentów enzymów restrykcyjnych;
– przy sporządzaniu mieszaniny reakcyjnej enzym dodaje się na końcu. Ponadto, należy pamiętać, że enzym restrykcyjny musi być przetrzymywany w temperaturze -20 stopni Celsjusza, stąd też pobyt ER poza zamrażarką powinien trwać możliwie jak najkrócej;
– trawienie enzymatyczne prowadzi się w warunkach temperaturowych podanych przez producenta enzymu;
– przerwanie trawienia (zahamowanie aktywności enzymu) można wywołać na kilka sposobów. Najczęściej mieszaninę reakcyjną podgrzewa się do temperatury 65-80°C i utrzymuje przez 10-15 minut. Czasami producent zaleca dodanie do mieszaniny reakcyjnej EDTA, lub ekstrakcję fenolem. Związane jest to z właściwością enzymów – niektóre enzymy restrykcyjne są termostabilne i trudno ulegają termicznej inaktywacji.
Aktywność „star” enzymów restrykcyjnych
Pojawienie się aktywności „star”, czyli niespecyficznego wykrywania i cięcia nici DNA w reakcjach z udziałem enzymów restrykcyjnych, zależy od wielu czynników. Aktywność „star” jest zwykle niepożądana, gdyż obniża specyfikę reakcji, wprowadza zmienność do przeprowadzanego eksperymentu, przez co utrudnia interpretację otrzymywanych wyników. Aktywność „star” pojawia się najczęściej w sytuacjach, kiedy reakcje prowadzi się używając kilku enzymów restrykcyjnych naraz (cięcie wielokrotne). Wówczas trudne jest zapewnienie warunków optymalnych dla każdego użytego enzymu.
Co stymuluje aktywność „star”?
– zbyt wysokie stężenie glicerolu, będącego składnikiem buforów do przechowywania enzymów oraz innych odczynników organicznych (DMSO, etanol, glikol i inne);
– zbyt wysokie stężenie enzymu względem DNA użytego do trawienia (po izolacji lub reakcji PCR);
– zbyt niska siła jonowa (<25mM);
– wysokie pH (>8,0)[2];
– zastąpienie jonów Mg2+ innymi jonami metali dwuwartościowych: (np.: jonami manganu, miedzi lub cynku).
Jak zapobiegać aktywności „star” enzymów restrykcyjnych?
Aby zapobiegać pojawianiu się niespecyficznych aktywności należy:
– używać enzymów w minimalnej ilości, niezbędnej do pocięcia danej ilości DNA. Przykładowo, im mniejsza objętość enzymu, tym niższa stężenie glicerolu w próbce – należy przy tym pamiętać, że czas reakcji trawienia powinien zostać wydłużony;
– w miarę możliwości należy usunąć inne zanieczyszczenia organiczne, tj. np.: etanol używany do izolacji DNA;
– zapewnić odpowiednią siłę jonową oraz pH mieszaniny reakcyjnej (aktywność niektórych enzymów może być hamowana przez wysoką siłę jonową, z reguły wzrost siły jonowej powoduje spadek aktywności jonów, z kolei wyższe pH roztworu może być efektem używania niewystarczająco czystego DNA izolowanego metodą lizy alkalicznej);
– używanie jonów magnezu, jako czynnika wspomagającego pracę enzymu, jednocześnie należy unikać zanieczyszczeń innymi, dwuwartościowymi jonami.
Autor: Marcin Pastwa
Literatura:
Watson J.D., Gilman M., Witkowski J., Zoller M. Recombinant DNA. Scientific American Books, 2nd ed.,1992;
Primrose S.B. Principles of Gene Manipulation. Blackwell Scientific Publications, 4th ed.,1989;
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning. CSHL Press, second edition1989;
Słomski R. Przykłady analiz DNA. Wydawnictwo Akademii Rolniczej w Poznaniu, 2001.
New England Biolabs, Inc.
Polisky B., Greene P., Garfin DE., McCarthy BJ., Goodman HM., Boyer HW. Specificity of substrate recognition by the EcoRI restriction endonuclease.. „Proc Natl Acad Sci U S A”. 02;72. 9, 3310-4, 1976.

