Autorką artykułu jest Elwira Smakowska – studentka biotechnologii na Uniwersytecie Wrocławskim.
Chromatografia jako metoda oczyszczania białek
Preparacja białek jest niezwykle skrupulatnym i wieloetapowym procesem. Wymaga zabiegów, w których wykorzystuje się zarówno fizyczne jak i chemiczne właściwości danej molekuły. Wydzielanie białek w stanie natywnym, o możliwie najwyższym stopniu oczyszczenia, wymagaodpowiedniego dobrania technik i warunków preparacji. Pozwala to w późniejszych etapach na dokładne określenie struktury przestrzennej oraz molekularnych mechanizmów działania pozyskiwanego białka. Już ponad kilka tysięcy białek udało się oczyścić w stanie aktywnym w oparciu o takie ich cechy jak: wielkość, rozpuszczalność, ładunek i specyficzne powinowactwo wiązania.
Na odpowiednim kroku preparacji małe cząsteczki można oddzielić od białka metodą dializy przez błonę półprzepuszczalną. Generalnie metodę tą stosuje się do odsalania roztworu białek, do wymiany w roztworze białka jednego buforu na inny, bądź do oddzielenia związków drobnocząsteczkowych od makrocząsteczek. Jednakże jeśli chcemy rozdzielić mieszaninę białek różniących się wielkością, dogodnym krokiem będzie zastosowanie filtracji żelowej (sączenia molekularnego). Rozdział następuje podczas przepływu mieszaniny białek (lub białka i soli) przez kolumny napełnione porowatym nośnikiem, zbudowanym z silnie uwodnionego polimeru typu dekstranu lub agarowy ( powszechnie stosowane żele to: Sephadex, Sepharose, Bio-gel). Podczas rozdziału małe cząsteczki wnikają do wnętrza owych ziaren żelu, podczas gdy duże nie. W rezultacie małe cząsteczki pozostają rozproszone w roztworze wodnym, znajdującym się w ziarnach żelu oraz pomiędzy nimi, natomiast duże znajdują się jedynie w roztworze wodnym wypełniającym przestrzenie pomiędzy ziarnami żelu. Objętość kolumny, która jest dostępna dla dużych cząstek jest mniejsza niż dla cząstek mały, w związku z czym większe białka przepływają przez kolumnę szybciej i wypływają jako pierwsze.
W artykule tym przyjrzymy się bliżej chromatografii jonowymiennej, jako jednej z najbardziej popularnych metod rozdziału mieszanin wieloskładnikowych. Separacja makromolekuł w chromatografii jonowymiennej polega na odwracalnej adsorpcji obdarzonych ładunkiem elektrycznym makromolekuł na złożu jonowymiennym (jonowymieniaczu). Wymieniacz jonowy jest substancją, która w zetknięciu z roztworem wymienia część swoich jonów na jony z roztworu. W jego strukturze można wyróżnić nierozpuszczalną matrycę połączoną wiązaniami kowalencyjnymi z określonymi grupami funkcyjnymi, które ulegają jonizacji i mogą w sposób odwracalny asocjować z jonami przeciwnego znaku, tzw. przeciwjonami. Ze względu na ładunek jonów które podlegają wymianie wyróżniamy dwa rodzaje jonowymieniaczy:
* Kationity (polianiony) wymieniają kationy z roztworem
* Anionit (polikation) wymieniają aniony z roztworem
Kationy i aniony będące jonami wymiany, czyli tzw. przeciwjonami pochodzą z roztworu buforowego używanego do równoważenia złoża. Podczas rozdziału chromatograficznego są one zastępowane przez obdarzone ładunkiem cząsteczki białka.
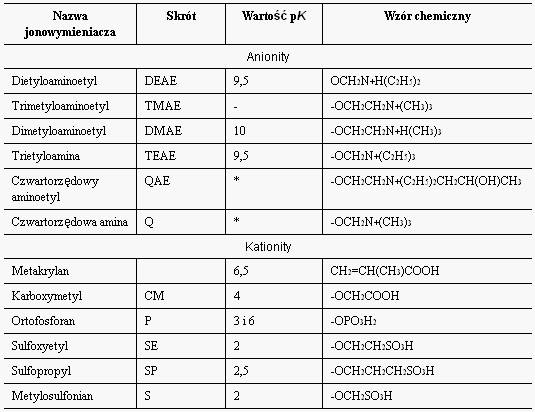
Tab.1. Grupy funkcyjne jonowynieniaczy. /* Dla amin czwartorzędowych nie podano wartości pK, ponieważ niezależnie od wartości pH otoczenia grupy te zawsze zachowują swój ładunek elektryczny.
W obrębie obu grup wymieniaczy spotkać można różne grupy funkcyjne odpowiedzialne za ekspozycję odpowiedniego ładunku elektrycznego. W zależności od wartości pK, charakteryzującej grupę funkcyjną, wymieniacz zaliczany jest do jonowymieniaczy silnych bądźsłabych. I tak np. DEAE- słabo zasadowy anionit, QAE- silnie zasadowy anionit, CM- słabo kwaśny kationit, SP-; SE- słabo kwaśne kationity.
Jeśli chodzi o nośniki stosowane w tego typu chromatografii jest to głównie celuloza, Sepharose, Sephadex oraz Bio-Gel. Inną bardzo ważna cechą charakteryzującą złoże jest pojemność jonowymieniacza, czyli liczba równoważników wymienianych jonów (w miliwatach) przypadająca na 1 g złoża.
Możemy wyróżnić kilka etapów rozdziału białek w chromatografii jonowymiennej:
* Naniesienie mieszaniny białek na kolumnę chromatograficzną
* Adsorpcja białek o odpowiednim ładunku
* Desorpcja, czyli elucja białek związanych do złoża
* Regeneracja złoża
Wybór warunków chromatografii jonowymiennej:
1. Jeśli znamy pI białka:
• Białka zasadowe – pI tych białek przypada w zakresie pH zasadowego: stosujemy kationit (polianion). Nanosimy białko w pH niższym niż pI. Np. białko o pI 8 będzie kationem w pH np. 6,5 i zwiąże się do kationitu. Elucja: bufor o wyższym pH niż pH nanoszonego roztworu białka
• Białka kwaśne – o pI przypadającym w pH kwaśnym: stosujemy anionit (polikation). Nanosimy próby w buforze o pH wyższym niż pI białka. Np. białko o pI 2,5 będzie anionem e pH 3,7 i zwiąże się do anionitu. Elucja: bufor o pH niższym niż to w którym nanoszono białko.
2. Elucje białka z kolumny można prowadzić dwoma sposobami:
• Zmiana pH buforu, którym przemywamy złoże
• Zwiększenie siły jonowej eluentu
Bufory jakich używamy w chromatografii jonowymiennej:
1. Dla kationitów: fosforanowy, octanowy, cytrynianowi, maleinowy, weronalowi, HEPES
2. Dla anionitów: Tris, bis-Tris, etanoloamina, imidazol
Wracając do drugiego sposobu elucji, możemy tego dokonać zwiększając stężenie wcześniej używanego buforu, bądź dodając do buforu soli obojętnej (KCl, NaCl). Mając na względzie jakoś i dokładność prowadzonego rozdziału, należy odpowiednio dobrać szybkość przepływu oraz gradient użytej soli (liniowy, schodkowy). Im wolniejszy będzie przepływ i mniej gwałtowny przyrost stężenia np. NaCl tym rozdział będzie dokładniejszy.
Podsumowanie:
Wady i zalety chromatografii jonowymiennej
Zalety:
– wysoka rozdzielczość metody oraz znaczna jej selektywność,
– możliwość stosowania próbek o objętościach znacznie przekraczających objętość kolumny i o bardzo niskiej koncentracji separowanych makromolekuł,
– możliwość zatężania rozdzielanych makromolekuł przy pracy w technice gradientowej,
– duża pojemność kolumny (wysokość co najmniej 15 cm).
Wady:
– konieczność stosowania próbek w roztworze o niskiej sile jonowej i dokładnie określonej wartości pH,
– rozdzielone molekuły wymywane są zwykle w eluencie o wysokiej zawartości soli, którą trzeba później usunąć innymi technikami.
Zobacz również:
Chromatografia cieczowa
Chromatografia cienkowarstwowa
Chromatografia gazowa
Literatura:
1. Stryer L. „Biochemia”. Wydawnictwo Naukowe PWN, Warszawa 2003
2. J. Sambrook, D.W. Russel “Molecular Cloning. A laboratory Manual”. ColdSpringHarbor Laboratory Press, Cold Spring Harbor, New York. Third Edition 2001
3. http://www.p.lodz.pl/biofizyka/ch5.pdf

