PRZEDRUK, oryginał dostępny pod adresem www
Instrukcja do ćwiczeń laboratoryjnych
Laboratorium z chemii organicznej
Politechnika Śląska (www)
Wydział Chemiczny (www)
Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii (www)
Kierownik Katedry: dr hab. inż. Mirosław Gibas prof. Politechniki Śląskiej
Adres:
ul. B. Krzywoustego 4
44-100 Gliwice
Wprowadzenie do chromatografii
Chromatografia jest techniką analityczną i preparatywną wykorzystującą rozdzielanie mieszanin substancji na poszczególne składniki, bądź ich grupy (frakcje), dzięki różnicom w zachowaniu się tych składników w układzie dwóch faz, w których jedna nie zmienia swego położenia (faza nieruchoma, stacjonarna), druga zaś porusza się względem pierwszej w określonym kierunku (faza ruchoma, roztwór rozwijający).
Ze względu na rodzaj dominującego mechanizmu procesu rozdziału chromatografie możemy podzielić na:
a) adsorpcyjną – gdy fazą ruchomą jest ciecz lub gaz, a nieruchomą ciało stałe o właściwościach adsorbujących i odpowiednim rozdrobnieniu (np. żel krzemionkowy, tlenek glinowy, węgiel aktywny itp.). Rozdział jest powodowany różnicami współczynników adsorpcji.
b) podziałową – gdy fazą ruchomą jest ciecz lub gaz, a stacjonarną ciecz zatrzymana na odpowiednim nośniku (bibuła, ziemia okrzemkowa, kulki szklane itp.). Rozdział jest wynikiem różnic współczynników podziału.
c) jonowymienną – gdy fazą ruchomą jest ciecz, a stacjonarną wymieniacz jonowy. Rozdział zależy od różnic w sile wiązania składników przez wymieniacz.
d) żelową – gdy fazą ruchomą jest ciecz, a nieruchomą granulowany, jednorodny spęczniały żel. Rozdział jest powodowany różnicami w zdolnościach dyfundowania do cząsteczek żelu, a więc różnicami w wielkości cząsteczek składników.
W zależności od rodzaju fazy rozdzielczej i natury eluentu czyli substancji w której rozpuszcza się badaną mieszaninę rozróżnia się następujące techniki chromatograficzne:
a) chromatografia gazowa – to analityczna technika chromatograficzna, w której fazą nośną jest gaz (zazwyczaj hel, argon lub wodór). Chromatografia gazowa jest najczęściej stosowaną metodą do szybkiej analizy złożonych mieszanin związków chemicznych oraz oceny czystości tych związków.
b) chromatografia cieczowa –chromatografia, w której eluentem jest ciecz. Istotą każdej chromatografii cieczowej jest rozdział analizowanej mieszaniny na poszczególne związki chemiczne poprzez przepuszczanie roztworu tej mieszaniny przez stałe lub żelowe złoża. Na skutek oddziaływań międzycząsteczkowych między związkami tworzącymi mieszaninę a złożem jedne z nich przechodzą przez złoże szybciej a inne wolniej.
c) chromatografia kolumnowa – w której faza rozdzielcza jest umieszczona w specjalnej kolumnie, przez którą przepuszcza się następnie roztwór badanej mieszaniny. Przepływ roztworu przez kolumnę można wymuszać grawitacyjnie lub stosując różnicę ciśnień na wlocie i wylocie kolumny.
d) chromatografia planarna – rozdział chromatograficzny jest prowadzony, gdy faza stacjonarna jest w postaci cienkiej warstwy.
Chromatografię planarną można jeszcze podzielić na:
– chromatografię bibułową (PC) której podstawą działania jest podział substancji rozdzielanych miedzy fazę nieruchomą, którą stanowi woda unieruchomiona przez celulozę dzięki jej higroskopijności, oraz fazę ruchomą rozpuszczalnik organiczny lub mieszaninę rozpuszczalników, często nawet z wodą, wędrujące po bibule dzięki siłom kapilarnym. Celuloza stanowiąca nośnik dla fazy stacjonarnej (wody) ma niewielkie właściwości adsorpcyjne i prawie nie zniekształca przebiegu rozdzielania opartego na podziale substancji między wodę a wędrujący rozpuszczalnik. Jeżeli współczynniki podziału substancji naniesionych na bibułę są różne, to w trakcie wędrówki po bibule następuje ich rozdzielenie
– chromatografię cienkowarstwową (TLC) – w której fazę nieruchomą nanosi się w postaci cienkiej równomiernej warstewki na płytkę szklaną, arkusz folii aluminiowej czy tworzywa sztucznego.
Chromatografia cienkowarstwowa
Chromatografia cienkowarstwowa (TLC – z ang. Thin Layer Chromatography) jest najpopularniejszą metodą szybkiego sprawdzania postępu reakcji chemicznej i czystości produktu. Może być także wykorzystywana do identyfikacji związków zarówno organicznych jak i nieorganicznych. W chromatografii cienkowarstwowej mieszanina substancji jest rozdzielana na poszczególne składniki ze względu na różnice w szybkości ich przemieszczania się na podłożu wykonanym z aktywnego adsorbenta stanowiącego fazę nieruchomą. Poszczególne składniki mieszaniny z różną siła wiążą się z polarnym adsorbentem, a następnie wymywane są z niego rozpuszczalnikiem stanowiącym fazę ruchomą. Im bardziej polarna jest badana substancja, tym silniej wiąże się z fazą stałą i tym trudniej jest wymywana przez eluent. Im bardziej polarny jest eluent, tym więcej polarnych centrów aktywnych fazy stałej jest przez niego blokowane, co zmniejsza „opory” przesuwania się eluowanych substancji.
W chromatografii cienkowarstwowej faza stacjonarna jest naniesiona w postaci cienkiej warstwy o grubości od 0,1 do 0,25 mm na płytkę szklaną lub metalową lub z tworzywa sztucznego o wymiarach 200x200mm, 200×50 mm lub100x50 mm. Naniesiona warstwa musi być mechanicznie trwała i odporna na ocieranie Najczęściej do fazy stacjonarnej dodaje się 0.1 – 10 % tzw. lepiszcza, którym może być gips, skrobia, sole kwasów poliakrylowych i inne. Ze względu na detekcję substancji warstwy chromatograficzne zawierają także często trwale zaadsorbowany wskaźnik fluorescencyjny.
W chromatografii cienkowarstwowej, podobnie jak w kolumnowej, do rozdzielania są wykorzystywane te same mechanizmy oddziaływań międzycząsteczkowych, a więc adsorpcja, wymiana jonowa, podział, czy warunki układu faz odwróconych. Jednakże ciągle dominującą rolę (w przeciwieństwie do chromatografii kolumnowej) odgrywa adsorpcja, a najczęściej stosowanymi adsorbentami są:
A) Żel krzemionkowy – jest jednym z najbardziej popularnych adsorbentów stosowanych w chromatografii cienkowarstwowej. Jest on otrzymywany przez hydrolizę krzemianu sodu, jego kondensację i polimeryzację w trakcie prażenia. Jego struktura wygląda w przybliżeniu następująco:
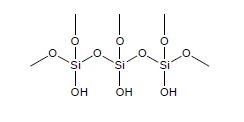
Aktywność żelu krzemionkowego zapewniają grupy Si-OH (silanolowe) obecne na jego powierzchni. Wytwórcy kontrolują aktywność na etapie prażenia. Żel stosowany w TLC ma średnicę ziaren w zakresię 5-10 mm. Typy żelu krzemionkowego oznaczane są często w sposób następujący:
– Żel krzemionkowy G – zawiera 13% gipsu jako czynnika wiążącego
– Żel krzemionkowy H bez środka wiążącego
– Żel krzemionkowy F254 z fluorescentem
– Żel krzemionkowy UV254 z fluorescentem
Jako fluorescent zazwyczaj stosowany jest siarczek cynku. Żel krzemionkowy ma odczyn lekko kwaśny i może być stosowany do rozdziału sterydów, aminokwasów, węglowodorów, tłuszczów, alkaloidów itp.
B) Tlenek glinu – aktywność tlenku glinu związana jest z obecnością zarówno atomów tlenu jak i glinu. Metoda produkcji polega na kondensacji uwodnionego wodorotlenku glinu. Może on być produkowany w trzech odmianach kwasowości powierzchni: formie kwasowej, zasadowej i obojętnej. Zasadowy tlenek glinu z w/w jest najbardziej popularny.
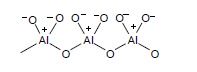
Tlenek glinu jest używany do rozdziału sterydów, barwników, witamin i alkaloidów.
C) Celuloza jest naturalnym polisacharydem zbudowanym z cząsteczek glukozy połączonych wiązaniami beta (1,4) glikozydowymi. Płytki TLC pokryte są cząsteczkami celulozy o podobnej wielkości ziaren, co powoduje regularny przepływ rozpuszczalnika. Celuloza jest stosowana do rozdziału związków hydrofilowych, rozpuszczalnych jonów nieorganicznych i kwasów nukleinowych, które mogą zbyt silnie oddziaływać z tlenkiem glinu lub krzemionką. Oprócz tych typowych sorbentów w chromatografii cienkowarstwowej stosuje się także proszek poliamidowy, modyfikowane celulozy o właściwościach jonowymiennych oraz żele organiczne o właściwościach sit molekularnych np. Sephadex, BioGel P i inne.
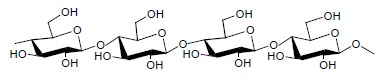
D) Z nieorganicznych adsorbentów stosowanych w chromatografii cienkowarstwowej można wymienić szkło sproszkowane, krzemian wapnia, hydroksyapatyt, siarczan wapnia, tlenek cyrkonu, tlenek tytanu a nawet tlenek żelaza.
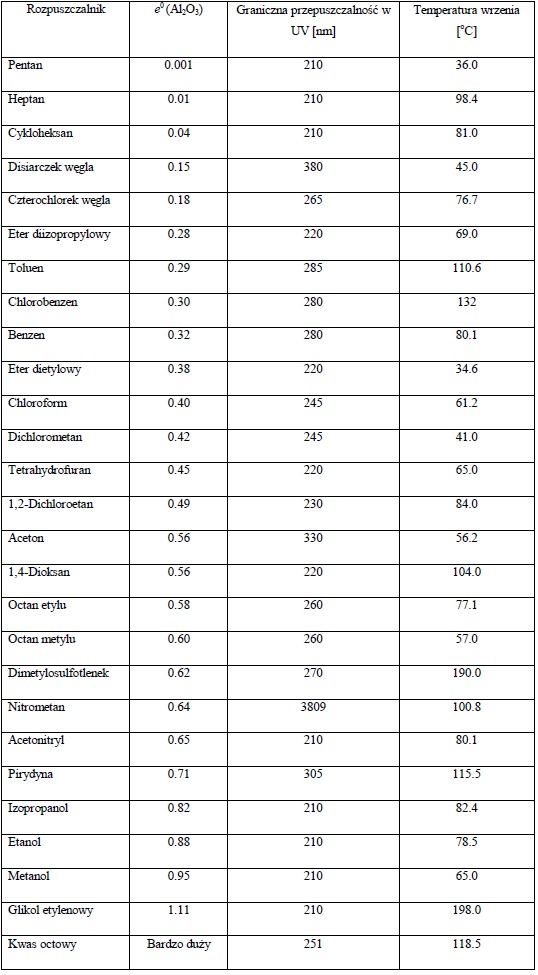
Natomiast fazę ruchomą stanowią zazwyczaj rozpuszczalniki organiczne. Powinny one być neutralne w odniesieniu do rozdzielanych substancji, wykazywać znaczną lotność par, co znacznie ułatwia osiągnięcie równowagi ciecz-para, i niską gęstość, co przyspiesza usunięcie rozpuszczalnika z powierzchni płytki. W celu określenia siły oddziaływań pomiędzy fazą ruchomą a powierzchnią nośnika wprowadzono parametr siły rozpuszczalnika e0. Jest to energia adsorpcji na jednostkę powierzchni standardowego adsorbenta (e0 jest równe zero na tlenku glinu eluowanym pentanem). Generalnie, im większe wartości e0 tym silniej rozpuszczalnik oddziałuje z powierzchnią adsorbenta i tym łatwiej cząsteczki związku będą się przemieszczały co prowadzi do większej wartości Rf (Warto zauważyć, iż im większa polarność eluenta, tym większe e0). Wartości Rf substancji w każdej fazie ruchomej będą zależne od różnicy w wartości siły rozpuszczalnika. Parametr mocy rozpuszczalnika, który może być zmierzony daje szereg elucyjny rozpuszczalników zamieszczony w tabeli poniżej.
Dobór odpowiedniego układu rozpuszczalników opiera się na zasadzie: podobny rozpuszcza się w podobnym. Zazwyczaj wykonuje się kilka prób (zmieniając polarność eluentu), dążąc do osiągnięcia wartości Rf pomiędzy sąsiednimi plamkami przynajmniej 0.1 mm. Przy czym najniższa z plamek powinna przesunąć się z linii startowej przynajmniej o kilka milimetrów. Często także korzysta się z danych literaturowych. W wielkim uproszczeniu zjawiska zachodzące w komorze chromatograficznej można przedstawić następująco: faza ruchoma dzięki siłom kapilarnym migruje wzdłuż warstwy sorbentu (fazy stacjonarnej) i w zależności od energii oddziaływań substancji z fazami wykazują one różny stopień retencji, tzn. mają różną drogę migracji i znajdują się w różnych miejscach warstwy.
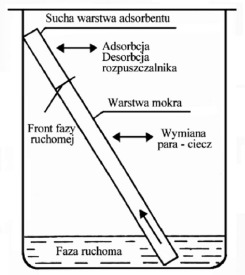
Rys.1. Schematyczny obraz procesów zachodzących w czasie rozwijania chromatogramu na płytce chromatograficznej
Najbardziej powszechnym sposobem rozwijania płytek chromatograficznych jest sposób liniowy, który w najprostszej postaci wymaga tylko kontaktu jednego końca płytki (warstwy chromatograficznej) z rozpuszczalnikiem. Płytkę chromatograficzną ustawia się w pozycji pionowej bądź pod kątem w kilku mililitrach rozpuszczalnika w odpowiednim pojemniku zwanym komorą chromatograficzną Rozwijanie liniowe może być jednokierunkowe lub dwukierunkowe. Płytkę można rozwijać pojedyncze lub wielokrotne. W rozwijaniu jednokierunkowym faza ruchoma przesuwa się w jednym kierunku zaś rozwijanie dwukierunkowe polega na tym, że po pierwszym rozwinięciu płytkę suszy się w celu usunięcia rozpuszczalnika a następnie zanurza w tym samym rozpuszczalniku lub innym, ale obróconą o 90 stopni. Przy wielokrotnym rozwijaniu płytkę po każdej analizie suszy się i ponownie rozwija stosując taką samą fazę ruchomą lub inną. Efektem tego sposobu rozwijania jest zwężenie pasma stężeniowego substancji i związane z tym zwiększenie sprawności układu jak również zwiększenie czułości metody.
Po rozwinięciu płytki chromatograficznej i wysuszeniu wizualizacje „plamek” na warstwie chromatograficznej można dokonać m.in. metodami fizycznymi, chemicznymi lub biologicznymi.
Do metod fizycznych zaliczamy fotometrie absorpcyjną, fluorescencje, fosforescencje (w przypadku substancji znakowanych izotopami promieniotwórczymi) oraz metody radiometryczne. Metody te nie powodują uszkodzenia próbki co ma istotne znaczenie jeśli stosuje się chromatografie cienkowarstwową do celów preparatywnych. Do wizualizacji plamek można także wykorzystać metody chemiczne. Wówczas rozdzielane substancje przeprowadza się w substancje barwne stosując do tego celu reagenty chemiczne, które ulegają reakcji z wybranymi grupami funkcyjnymi. Stosunkowo często stosowanym wywoływaczem jest stężony kwas siarkowy. Proces wywoływania polega na spalaniu substancji organicznych i pojawianiu się ciemnych plam na warstwie chromatograficznej. Inne popularne wywoływacze zostały zamieszczone w tabeli 4.
Natomiast biologiczne metody wywoływania chromatogramów mają zastosowanie w badaniach substancji czynnych, występujących w żywych ustrojach, np. enzymów, koenzymów, aktywatorów i inhibitorów enzymatycznych. Na przykład w badaniach przemian enzymatycznych nanosi się badany materiał na bibułę i rozpyla roztwór preparatu enzymatycznego. Inkubację przeprowadza się w termostacie w temp. 37-38°C, a po jej zakończeniu, rozwinięciu chromatogramu i wywołaniu właściwym testem, identyfikuje się produkty reakcji enzymatycznej.
Tabela 4. Roztwory stosowane do wizualizacji substancji na płytkach TLC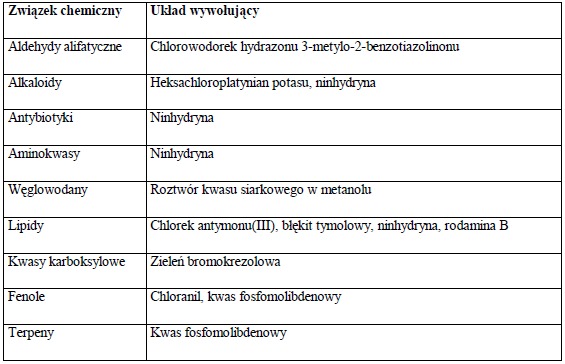
Wykonanie analizy TLC
Badane substancje (10-20 mg) rozpuszcza się w niewielkiej ilości rozpuszczalnika ok. 0.5 ml. Substancja powinna być dobrze rozpuszczalna w zastosowanym rozpuszczalniku, najczęściej stosuje się roztwory w metanolu, acetonie, chloroformie. W przypadku substancji bardzo polarnych np. aminokwasy do roztworu można dodać 1 kroplę wody. Przygotowuje się płytkę chromatograficzną o wymiarach zależnych od ilości substancji jakie zamierza się nałożyć na płytkę. Na przygotowanej płytce zaznacza się przy użyciu zwykłego ołówka punkty, na które następnie nanosi się roztwory substancji badanych, przy pomocy szklanej kapilary, w odległości ok. 0.5 cm od bocznej krawędzi płytki oraz ok. 0.5 cm od dolnej krawędzi. Roztwór nanosi się lekko dotykając powierzchni płytki końcem kapilary(czynność można powtórzyć kilkakrotnie). Dobrze naniesiona substancja tworzy na płytce tzw. „plamkę” o średnicy ok. 2 mm. Po nałożeniu wszystkich substancji płytkę suszy się, a następnie ostrożnie zanurza się dolną krawędzią w roztworze rozwijającym, znajdującym się w komorze chromatograficznej, tak by nie zanurzyć plamek. Komora powinna być umieszczona pod sprawnie działającym wyciągiem. Rolę komory chromatograficznej z powodzeniem spełnia zwykły słoik przykryty szkiełkiem zegarkowym. Dla lepszego nasycenia komory parami rozpuszczalnika, ścianę boczną komory wyściela się paskiem z bibuły. Czoło rozpuszczalnika powoli przemieszcza się po płytce, aż do osiągnięcia linii końcowej tj. ok. 5 mm od górnej krawędzi płytki. Wówczas płytkę ostrożnie wyjmujemy z komory. Rozpuszczalnik pozostały na płytce usuwa się za pomocą zwykłej suszarki do włosów. W przypadku związków absorbujących w UV, wizualizację plamek dokonuje się przez włożenie płytki do komory lampy UV, pod warunkiem, że adsorbent znajdujący się na płytce zawiera dodatek fluorescenta. Wtedy na żółto zabarwionej w świetle UV płytce substancje widać jako ciemne plamki. Inna metoda wizualizacji plamek polega na umieszczeniu płytki w komorze jodowej lub krótkotrwałym zanurzeniu w naczyniu z odpowiednim roztworem wywołującym a następnie wygrzaniu płytki w podwyższonej temperaturze (zazwyczaj nie wyższej niż 120 oC). Wraz z przesuwaniem się rozpuszczalnika przemieściły się nałożone substancje. Szybkość ich przemieszczania jest ich cechą indywidualną i zależy od ich powinowactwa do podłoża płytki (adsorbcja) i wymywania (desorpcja). W wyniku różnej szybkości migracji poszczególnych substancji w danych warunkach, na płytce chromatograficznej powstaje seria plamek w różnej odległości od linii startowej. Położenie plamek zaznacza się przez lekkie obrysowanie ich krawędzi ołówkiem bezpośrednio po wywołaniu. Następnie obliczamy tzw. współczynnik Rf (współczynnik retencji). Mierzy się odległość środka plamki od linii startowej (w mm) i dzieli przez dystans pomiędzy linią startową i końcową też w mm. Pomiaru i obliczenia Rf dokonuje się dla każdej plamki. Na rys.2 przedstawiono sposób pomiaru Rf.
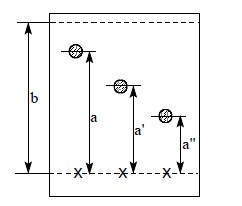
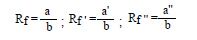
Rys. 2. Sposób pomiaru i obliczania Rf.
Odmianą chromatografii cienkowarstwowej (TLC) jest preparatywna chromatografia cienkowarstwowa (PTLC) którą stosuje się w celu izolacji znacznie większych ilości substancji, które następnie mogłyby być stosowane dla celów preparatywnych. Jest to możliwe gdyż stosuje się płytki o znacznie większych wymiarach niż analityczne. Najczęściej stosowane są płytki wymiarach 20×20 cm i grubości warstwy 1,0-2,0 mm. Postępowanie w przypadku stosowania preparatywnej chromatografii cienkowarstwowej jest podobne jak w przypadku stosowania konwencjonalnej czy wysokosprawnej warstwy. Na warstwę chromatograficzną nakłada się rozdzielaną mieszaninę substancji w formie paska lub plamek obok siebie. Ilość nakładanej substancji zależy od grubości warstwy żelu oraz od trudności rozdzielczych w danym układzie. Po rozwinięciu płytki w komorze zawierającej układ rozwijający i po wysuszeniu płytkę wywołuje się stosując metody nieinwazyjne jak np. wizualizację za pomocą lampy UV.
Zobacz również:
Chromatografia cieczowa
Chromatografia jonowymienna
Chromatografia gazowa

