Enzymy to specyficzne białka, występujące w każdym organizmie żywym i nie tylko – wirusy jako struktury nieożywione także posiadają własne enzymy takie jak ligaza i odwrotna transkryptaza. Ich zadaniem jest przyspieszanie – katalizowanie – reakcji zachodzących wewnątrz komórek. Enzymy, z racji na mnogość reakcji zachodzących w komórce muszą charakteryzować się jeszcze właściwościami uzasadnionymi z punktu widzenia komórki i organizmu, a co więcej mogącymi być przedmiotem zainteresowania przemysłu.
Cechy enzymów
Do prawidłowego przebiegu procesów życiowych komórek konieczne jest kilka tysięcy substancji chemicznych, pozostających miedzy sobą w ścisłych proporcjach. Związki te to często substancje o długich łańcuchach – tak jak w przypadku białek lub kwasów tłuszczowych – z wieloma grupami funkcyjnymi – alkohole, aldehydy, ketony, kwasy, aminy, a także ich nieorganiczne pochodne – estry fosforanowe (np. ATP), sole, siarczany, bądź kompleksy z metalami – np. z cynkiem. Są to też w wielu wypadkach związki chiralne, co w przypadku organizmów żywych jest bardzo istotne. Analizując metabolizm organizmów żywych można zauważyć, że każda z reakcji kontrolowana jest przez bardzo konkretne enzymy – czasem jeden a czasem ich zespół. Oznacza to, że każdy enzym ma konkretne właściwości, pozwalające mu na reagowanie z – najczęściej – jednym substratem. Mnogość możliwych związków powoduje, że takich właściwości powinno być mnóstwo, jednakże prawda jest taka, że dla każdego enzymu możemy określić trzy charakterystyczne parametry, są to:
– chemoselektywność
– regioselektywność
– stereospecyficzność
Są to cechy które mogą być obecne w katalizatorach chemicznych, jednak rzadkością jest, by dany katalizator wykazywał na raz wszystkie trzy. W przypadku enzymów jest to praktycznie regułą. Pytanie jednak brzmi – co oznaczają te słowa?
Chemoselektywność – wybór jednej drogi z wielu
Związki chemiczne, w szczególności organiczne charakteryzują się często obecnością wielu grup funkcyjnych. Często są to grupy mogące reagować z identycznymi substratami w takich samych warunkach. Prowadząc reakcję drogą czysto chemiczną nie jesteśmy w stanie przewidzieć jaki będzie wynik reakcji – np. w przypadku prostej redukcji ketokwasu (związku zawierającego jednocześnie grupę ketonową i kwasową) nie jesteśmy w stanie stwierdzić która z tych grup – a może obie – zostanie zredukowana. Natura zna podobne przypadki – np. można się spytać, czemu wiązanie peptydowe w kwasie asparaginowym w białkach z organizmów żywych zawsze powstaje między grupą aminową i tylko jedną z dwóch możliwych grup karboksylowych? Odpowiedzią na to pytanie jest fakt, że enzymy charakteryzuje chemoselektywność – zdolność do selektywnego katalizowania reakcji jednej, konkretnej grupy funkcyjnej, nawet w obecności innych, podobnych, na których reakcje mogłyby zachodzić z takim samym powodzeniem.
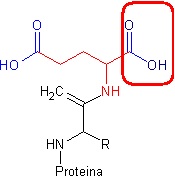
Rys. 1 Chemoselektywność doskonale widać na przykładzie kwasu asparaginowego. Aminokwas ten (czerwono-niebieski) posiada dwie grupy karboksylowe (niebieskie). Chemicznie sa one praktycznie identyczne, i z równie dużym prawdopodobieństwem mogłyby uczestniczyć w tworzeniu wiązania peptydowego. Jednakże, w momencie budowania białek, rdzeń białka będzie tworzony tylko poprzez grupę oznaczoną ramką
Regioselektywność – zainteresowanie tylko jedną możliwością
Z regioselektywnością spotkał się każdy biotechnolog w trakcie kursu chemii organicznej. Znana powszechnie reguła Miarkownikowa jest przykładem tej cechy. Prowadząc addycję elektrofilową do wiązań podwójnych węgiel-węgiel atom wodoru przyłącza się do tego atomu węgla, przy którym wcześniej było już więcej atomów wodoru. Enzymy, a dokładniej w tym wypadku reakcje enzymatyczne, bardzo często wykazują tą cechę. Typowym przykładem jest hydroksylowanie (przyłączenie grupy -OH) do kwasów tłuszczowych w trakcie ich metabolizmu. W tkankach zwierzęcych enzymy preferencyjnie katalizują hydroksylowanie na drugim atomie węgla za grupą karboksylową, atakując pierwszy tylko w przypadku zablokowania pozycji drugiej. Z kolei w roślinach, posiadających inny zestaw enzymów, preferowaną pozycją jest pozycja pierwsza.
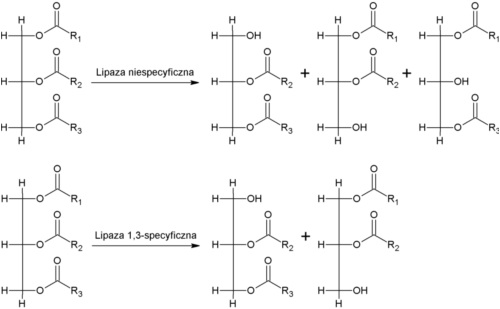
Rys. 2 Inny przykład regioselektywności – hydroliza tłuszczów przez lipazy. Lipazy nieregioselektywne będą losowo odcinać kwasy tłuszczowe z triacylogliceroli, niezależnie od ich pozycji. Lipazy 1,3-specyficzne będą powodować jedynie hydrolizę wiązań estrowych na terminalnych atomach węgla cząsteczki glicerolu
Najłatwiej można powiedzieć, że regioselektywność to cecha reakcji chemicznej, powodująca powstanie nadmiaru jednego z izomerów strukturalnych.
Warto też nadmienić, iż istnieją reakcje, w których dochodzi do otrzymania tylko jednego z dwóch możliwych izomerów, zaś drugi nie pojawia się wcale. Reakcje takie nazywamy regiospecyficznymi, i o ile w chemii spotyka się je rzadko, o tyle enzymy czasem wykazują tą cechę – np. oksygenaza hemu regiospecyficznie rozcina pierścień hemu, dając w efekcie biliwerdynę, tlenek węgla i żelazo.
Stereospecyficzność – tylko jeden izomer optyczny
Każdy biolog i biotechnolog zastanawiał się chociażby raz w życiu, jak to jest możliwe, że wszystkie aminokwasy w naszym organizmie są tylko L-aminokwasami, albo dlaczego glukoza znajdowana w organizmach żywych to D-glukoza, a nie jej enancjomer L. Przecież kurs chemii organicznej mówi, że cztery możliwe wiązania tworzone przez atom węgla są równocenne, i statystycznie, w klasycznej chemii powinniśmy składać się w połowie z L- i w połowie z D-aminokwasów – albo, w ekstremalnych warunkach, połowa dowolnej populacji powinna mieć odwróconą chiralność. Sytuacja ta wynika z tego, iż praktycznie każdy enzym wykazuje stereospecyficzność – czyli zdolność do katalizowania reakcji obejmujących lub tworzących tylko jeden z możliwych enancjomerów na danym atomie węgla. Jest to cecha wtórna – wynika ona z faktu, że enzymy same z siebie składają się tylko z L-aminokwasów, co oznacza, że same są chiralne, a także ich miejsce aktywne będzie miało strukturę chiralną, preferującą, bądź wręcz wybierającą tylko jeden z możliwych enancjomerów do danej reakcji.
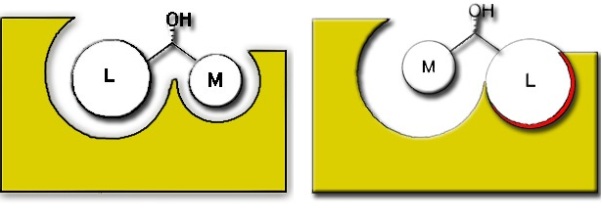
Rys. 3 Stereospecyficzność można bardzo łatwo wyjaśnić – wynika ona z obecności na chiralnym węglu podstawników o różnej wielkości, które mogą tylko w jeden sposób zostać dopasowane do miejsca aktywnego enzymu. W przypadku z powyższego rysunku preferowany będzie enancjomer z rysunku po lewej, a enancjomer z prawej będzie reagował wolniej, lub wręcz wcale
Te trzy cechy czynią z enzymów substancje absolutnie wyjątkowe, które można zastosować w wielu miejscach, gdzie klasyczna chemia nie dysponuje jeszcze tanimi i wydajnymi narzędziami. Cechy te są też pewną podstawą do stworzenia swoistego podziału enzymów na pewne grupy – podziału, który w warunkach organizmu żywego jest jednoznaczny, ale dla naukowca w laboratorium nie jest świętością. Ale o tym – w kolejnych artykułach.
Autor: Bartłomiej Koźniewski
Literatura:
1. Kurt Faber: Biotransformations in organic chemistry, 5th Ed., Springer-Verlag, Berlin Heidelberg New York 2004.
2. Halina Kalinowska, Alicja Buchowiecka, Stanisław Bielecki: Biokataliza Kosmos, Problemy Nauk Biologicznych, tom 56 (2007) nr 3-4, str. 327-334.
3. Definicje pojeć – IUPAC GOLD BOOK http://goldbook.iupac.org/

