Trehalaza (alfa,alfa-glukohydrolaza; EC 3.2.1.28; THA) specyficznie i nieodwracalnie hydrolizuje trehalozę do dwóch cząsteczek glukozy.
Występuje u bakterii, grzybów, bezkręgowców, roślin (gł. motylkowych) i niektórych ssaków. Roślinna trehalaza, podobnie jak drożdżowa, jest specyficznie hamowana przez antybiotyk walidamycynę A. Występuje we wszystkich organach roślin wyższych, gł. w kwiatach, korzeniach, liściach, ale i w pyłku Camellia Japonia oraz Liliom. Jej aktywność stwierdzono również u innych gatunków, takich jak pomidor, tytoń, trzcina cukrowa. U roślin motylkowych trehalaza występuje przede wszystkim w brodawkach korzeniowych.
Trehaloza i trehalaza w brodawkach korzeniowych roślin motylkowych
Poza sacharozą, coraz większą uwagę zwraca obecnie rola innego disacharydu – trehalozy, oraz rozkładającego ją enzymu – trahalazy (THA) w procesie symbiotycznego wiązania azotu atmosferycznego a zwłaszcza w metabolizmie węglowodanów w brodawkach korzeniowych roślin motylkowatych.
Endogenną trehalozę akumuluje niewiele roślin wyższych, wśród których szczególnym wyjątkiem są rośliny wskrzeszone (ang. resurrection plants) odporne na prawie całkowite odwodnienie, np. Selaginella lepidophylla – widliczka, Myrothamnus flabellifolia, Sporobolus staphianus. Poziom tego disacharydu może stanowić u nich 10-20 % suchej masy.
Pomimo rzadkiego występowania trehalozy wśród roślin wyższych, obecność enzymów odpowiedzialnych za jej biosyntezę i degradację jest powszechna. Podobna zależność ma miejsce u zwierząt.
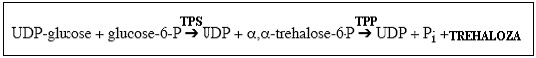
Trehaloza syntetyzowana jest w cytoplazmie, gdzie syntaza trehalozo-6-fosforanu (TPS) (EC. 2.4.1.15) katalizuje reakcję UDP-glukozy z glukozo-6-fosforanem. Powstający obok UDP, trehalozo-6-fosforan jest następnie defosforylowany przez fosfatazę trehalozo-6-fosforanu (TPP) (EC 3.1.3.12) do wolnej trehalozy. Ten szlak jest najczęstszą drogą syntezy trehalozy w warunkach stresu u roślin i innych organizmów. Jego obecność zidentyfikowano także u bakterii Bradyrhizobium japonicum i Bradyrhizobium elkanii.
Alternatywny szlak biosyntezy trehalozy wykryto u kilku bakterii. Pimelobacter sp., Thermus spp. i Mycobacterium spp. posiadają syntazę trehalozy (TreS) (EC 5.4.99.16) Katalizuje ona wewnątrzcząsteczkowe przegrupowanie maltozy, zmieniając wiązanie alfa-1,4-glikozydowe na alfa-1,1-glikozydowe. Jak dotąd nie wykryto istnienia tego szlaku u rizobiów.

Zbliżonym sposobem jest wykryta u Rhizobium sp. M-11 i Arthrobacter sp. Q 36, dwuetapowa konwersja maltooligosacharydów lub skrobi do wolnej trehalozy. Syntaza maltooligozylotrehalozy (MTS) (EC 5.4.99.15) katalizuje przekształcenie maltodekstryny do maltooligozylotrehalozy poprzez wewnątrzcząsteczkową transglikozylację przy końcu redukującym, przekształcając wiązanie -1,4-glikozydowe na -1,1-glikozydowe. Następnie trehalohydrolaza maltooligozylotrehalozy (MTH) (EC 3.2.1.141) hydrolizuje ten produkt uwalniając trehalozę i maltooligosacharydy o niższej masie cząsteczkowej. Dwa uczestniczące w tym szlaku enzymy amylolityczne stwierdzono u hypertermofilnej archebakterii Sulfolobus solfataricus KM1 i Sulfolobus acidocaldarius. Taki szlak biosyntezy trehalozy wykryto też u Bradyrhizobium japonicum, Bradyrhizobium elkanii, Rhizobium sp. NGR234, Sinorhizobium meliloti, Rhizobium tropici A, Rhizobium leguminosarum bv viciae, Rhizobium leguminosarum bv trifolii, Azorhizobium caulinodan. Prawdopodobnie nie występuje on u Rhizobium tropici B i Rhizobium etli.

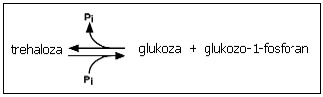
U grzybów, drożdży oraz u Euglena gracilis, Pichia fermentas, Scytonema sp., Anabaena cylindrica funkcjonuje fosforylaza trehalozy (EC 2.4.1.64), która w odwracalnej reakcji glukozy i glukozo-1-fosforanu katalizuje wytworzenie trehalozy i nieorganicznego fosforanu.

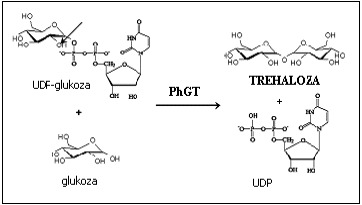
U archebakterii Pyrococcus horikoshii zidentyfikowano glukozylotransferazę (ang. P. horikoshii glycosyltransferase; PhGT), która przenosi cząsteczkę glukozy z UDP-, ADP-, lub GDP-glukozy na glukozę, a nie na glukozo-6-fosforan, jak w przypadku syntazy trehalozo-6-fosforanu. Produktem reakcji jest alfa, alfa, 1,1-trehaloza. PhGT może też częściowo hydrolizować trehalozę. Ze względu na właściwości i sekwencję aminokwasową oddziaływanie tego enzymu umieszczane jest ewolucyjnie pomiędzy reakcją fosforylazy trehalozy a działaniem syntazy trehalozo-6-fosforanu.
Obecność trehalozy wykazano w roślinach wchodzących w interakcje z produkującymi ją mikroorganizmami, takimi jak mikoryzalne grzyby, bakterie wiążące azot, czy promieniowce Frankia. Cukier ten służy im jako egzo- i endogenne źródło węgla. Szczególnie wysokie ilości trehalozy wykryto w brodawkach korzeniowych soi (Glycine max). Ok. 70% trehalozy znajduje się w bakteroidach, a 30% we frakcji roślinnej. Jednakże ilość wytwarzanej trehalozy zależy od genotypu bakterii, jak i jej roślinnego gospodarza. Trehaloza gromadzi się też m.in. w brodawkach Trifolium regens, Arachis hypogenus, Medicago sativa, Lotus corniculatus, jak i niestrączkowej olchy Alnus glutinosa.
Obecna u roślin motylkowatych trehaloza ma przypuszczalnie chronić przed nagromadzeniem się produkowanej przez mikroorganizmy egzogennej trehalozy, jak również tej, która potencjalnie może być endogennie wytwarzana przez roślinę. Stresogenne działanie trehalozy popiera fakt, że jej aplikacja indukuje w liściach pszenicy dwa odpowiadające na stres enzymy – peroksydazę i amoniakoliazę fenyloalaninową. Z drugiej strony, wytwarzanie glukozy poprzez rozkład trehalozy przez trehalazę, może wspomagać dostawę energii podczas procesu wiązania azotu atmosferycznego.
Marta Muszyńska
Literatura:
1. Aquino A.C.M.M., Peixoto-Nogueira S.C., Jorge J.A., Terenzi H.F., M.L.T.M. Polizeli (2005) „Characterisation of an acid trehalase produced by the thermotolerant fungus Rhizopus microsporus var. Rhizopodiformis: Biochemical properties and immunochemical localisation” FEMS Microbiology Letters 251:169-175
2. Bae H., Herman E., Sicher R. (2005) „Exogenous trehalose promotes non-structural carbohydrate accumulation and includes chemical detoxification and stress response proteins in Arabidopsis thaliana growth in liquid culture” Plant Science 168:1293-1301
3. El-Bashiti T., Hamamci H., Öktem H.A., Yöcel M. (2005) „Biochemical analysis of trehalose and its metabolizing enzymes in wheat under abiotic stress conditions” Plant Science 169:47-54
4. Engelhard M. (2004) „Trehalose and the nitrogen fixing nodule symbiosis of legumes: studies on rhizobia deficient in the trehalose-6-phosphate synthase gene „otsA” Inauguraldissertation zur Erlangung der Würde eines Doktors der Philosophie vorgelegt der Philosophisch-Naturwissenschaftlichen Fakultät der Universität Basel, Deutschland
5. Gárcia N.A.T., Iribarne C., López M., Herrera-Cervera J.A., Llunch C. (2005) „Physiological implications of trehalase from Phaseolus vulgaris root nodules: partial purification and characterization” Plant Physiology and Biochemistry 43:355-361
6. Goddijn O., Smeekens S. (1998) „Sensing trehalose biosynthesis in plants” The Plant Journal 14(2):143-146
7. Gueguen Y., Rolland J-L., Schroeck S., Flament D., Defretin S., Saniez M-H., Dietrich J. (2001) „Characterization of maltooligosyl trehalose synthase from the thermophilic archaeon Sulfolobus acidocaldarius” FEMS Microbiology Letters 194: 201-206
8. Müller J., Aeschbacher R.A., Wingler A., Boller T., Wiemken A. (2001) „Trehalose and Trehalase in Arabidopsis” Plant Physiology 125:1086-1093
9. Müller J., Wiemken A., Aeschbacher R. (1999) „Trehalose metabolism in sugar sensing and development” Plant Science 147:37-47
10. Roger A.A., Müller J., Boller T., Wiemken A. (1999) „Purification of the Trehalose GMTRE1 from Soybean Nodules and Cloning of Its cDNA. GMTRE1 Is Expressed at a Low Level in Multiple Tissues” Plant Physiology 119:489-495
11. Rolland F., Moore B., Sheen J. (2002) „Sugar Sensing and Signaling in Plants” The Plant Cell S185-S205
12. Ryu S.-I., Park C.-S., Cha J.C., Woo E.-J., Lee S.-B. (2005) „A novel trehalose-synthesizing glycosyltransferase from Pyrococcus horicoshii: Molecular cloning and characterization” Biochemical and Biophysical Research Communications BBRC 329:429-436
13. Schiraldi C., Di Lernia I., De Rosa M. (2002) „Trehalose production: exploiting novel approaches” TRENDS in Biotechnology 20/10:420-425
14. Wolska-Mitaszko B., Molestak E. (2002) „Mg-ATP w regulacji aktywności trehalazy z Medicago sativa” Journal of Elementology 7/4:294-299
15. Wolska-Mitaszko B., Molestak E., Małek W. (2005) „Properties of trehalase from different organs of alfalfa, Medicago sativa” Acta Physiologiae Plantarum 27/1:53-60
16. Wolska-Mitaszko B., Molestak E. (2005) „Metabolizm trehalozy u roślin” Postępy Biologii Komórki 32/2, 181-194

