Jednym z najpowszechniejszych produktów biotechnologicznych są enzymy – białka o specyficznej konfiguracji, pełniące w organizmach żywych rolę katalizatorów lub inhibitorów, regulujących aktywność konkretnych procesów. Człowiek nauczył się stosunkowo szybko wykorzystywać enzymy do swoich celów – początkowo pośrednio, na przykład w drodze słodowania zbóż, zaś później już bezpośrednio, pod postacią dodatków do detergentów, wolnych enzymów do scukrzania i upłynniania skrobi, do zmiękczania mięsa, do klarowania soków i innych celów. Stosunkowo młodym sposobem wykorzystania biokatalizatorów białkowych jest wykorzystanie ich w przemyśle, do celów syntezy organicznej. Jednakże takie zastosowanie wydaje się być silnie ograniczone – enzymy są substancjami, które naturalnie funkcjonują w środowisku wodnym – w żywych komórkach organizmów – często też w bardzo ściśle określonych warunkach temperatury, pH, stężeń soli, wymagają kofaktorów. Z drugiej strony mozna zauważyć nieustannie rosnącą ilość zgłoszeń dotyczących nowych przemysłowych metod enzymatycznych. Jak to jest możliwe?

Rys. 1 W takich bioreaktorach często przeprowadzane są reakcje enzymatyczne w skali laboratoryjnej. Należy pamiętać, ze często stosowane są też bioreaktory znacznie większe – na przykład w celu produkcji syropu glukozowego ze skrobi
Typowa komórka żywego organizmu jest skomplikowanym mechanizmem, w którym w każdej sekundzie zachodzą tysiące reakcji chemicznych, umożliwiających jej funkcjonowanie. Oznacza to, że w komórce znajduje się jednocześnie kilka tysięcy potencjalnych substratów, z których każdy może podlegać kilkunastu różnym reakcjom chemicznym. Wiele z nich jest potencjalnie toksyczne jeśli ich stężenie przekroczy konkretne wartości, a ich zbyt niskie stężenie może z kolei prowadzić do śmierci komórki z racji niedostarczenia odpowiednich substancji do życia lub funkcjonowania. Jeśli dołożymy do tego fakt, iż związki organiczne w żywym organizmie z reguły muszą wykazywać konkretną chiralność, co oznacza występowanie jedynie jako jedno z dwóch możliwych „lustrzanych odbić” cząsteczki, wydaje się niemożliwe, by organizm był w stanie odpowiednio skutecznie kontrolować reakcje w nim zachodzące. Okazuje się, że tak nie jest. Każda komórka jest wyposażona w zestaw substancji kontrolujących przebieg wszystkich, lub niemalże wszystkich reakcji w nich zachodzących.
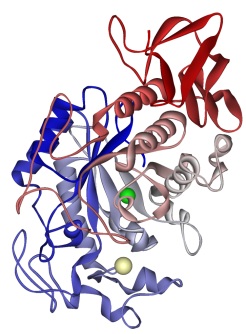
Rys. 2 Struktura ludzkiej alfa-amylazy ślinowej – jednego z podstawowych enzymów trawiennych, rozkładającego skrobię. Efekty jej działania można łatwo zauważyć przytrzymując dłuższą chwilę przeżuty kawałek chleba w ustach – z czasem zaczniemy odczuwać słodki smak. Alfa-amylaza jest też jednym z podstawowych enzymów przemysłowych – stosowana jest w browarnictwie, gorzelnictwie, i jako dodatek do detergentów
Za przebieg większości procesów w komórkach żywych odpowiadają białka. Pełnią one nie tylko funkcje strukturalne, budując organella komórkowe, ale też są odpowiedzialne za transport i przetwarzanie substancji znajdujących się w komórce, bądź mających się do niej dostać. Białka niejako „kontrolujące” przebieg procesów wewnątrzkomórkowych, jak też i niektórych zachodzących poza nią to właśnie enzymy. Są one biologicznymi odpowiednikami katalizatorów, dlatego też stosuje się w stosunku do nich nazwę „biokatalizatory”. Z racji działania enzymów w środowisku wodnym będą one zawsze białkami globularnymi, to znaczy o sferoidalnym (w przybliżeniu kulistym) kształcie. Zawierają od 62 reszt aminokwasowych (w monomerze tautomerazy 4-oksalokrotonowej, enzymie katalizującym przekształcenie 2-hydroksymukonianu do odpowiedniego αβ-nienasyconego ketonu w bakteryjnym szlaku metabolizmu toluenu, o-ksylenu i innych związków aromatycznych), do ponad 2500 (w syntazie kwasów tłuszczowych – wielofunkcyjnym polipeptydzie o kluczowej roli w biosyntezie kwasów tłuszczowych). Tak jak wszystkie białka, enzymy to długie łańcuchy aminokwasów, które dzięki odpowiedniemu zwinięciu tworzą silnie rozbudowaną, trójwymiarową strukturę o unikalnych właściwościach. Właśnie ta struktura ma wpływ na funkcję danego enzymu. Co prawda wiadomo, że wpływ ten jest decydujący, jednakże naukowcy wciąż nie są zgodni co do innych czynników mogących mieć wpływ na funkcje enzymatyczne danego białka.
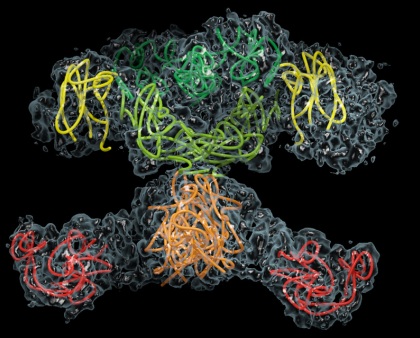
Rys. 3 Syntaza kwasów tłuszczowych – największy znany enzym, a de facto system multienzymatyczny, powiązany strukturalnie i funkcjonalnie. Enzym ten ma około dziesięciokrotnie większą masę od pokazanej wcześniej alfa-amylazy, i składa się z sześciu domen katalitycznych, z których każda odpowiada za pojedynczy typ reakcji. Obrazek przedstawia natywna formę syntazy – formę dimeryczną. Każdy z monomerów jest połową tego enzymu.
Rozmiary większości enzymów znacznie przekraczają rozmiary ich substratów. Faktycznym miejscem w którym zachodzi proces katalizy jest kilka, maksimum kilkanaście aminokwasów nazywanych „miejscem aktywnym”. Jest to miejsce na zwiniętej, trójwymiarowej cząsteczce białka, do którego wiązane są substraty w procesie katalizy. Zazwyczaj znajduje się ono w kieszeni lub zagłębieniu struktury cząsteczki enzymu. Substraty wiązane są do niego za pomocą wiązań wodorowych, oddziaływań hydrofobowych, bądź tymczasowych oddziaływań van der Waalsa. Jednakże, co zostało udowodnione już dla enzymów odpowiedzialnych za replikację DNA, często za identyfikację substratu odpowiadają nie tylko aminokwasy miejsca aktywnego, a także inne struktury obecne w cząsteczce enzymu.
Specyficzna struktura białek enzymatycznych powoduje, że są one jednymi z najwydajniejszych katalizatorów znanych w przyrodzie, bedących w stanie katalizować do kilkunastu milionów reakcji na sekundę. Przykładowo, niekatalizowana dekarboksylacja 5’-monofosforanu orotydyny ma okres półtrwania około 78 milionów lat. Dodanie enzymu – dekarboksylazy 5’-fosforanu orotydyny, powoduje skrócenie tego czasu do 25 milisekund – co oznacza przyspieszenie tej reakcji około 1016 razy.
Enzymy, z racji ich całkowitej biodegradowalności (jak wszystkie białka) i wysokiej wydajności mogą być doskonałymi, bezpiecznymi dla środowiska katalizatorami przemysłowymi. Niestety wydaje się, że fakt, iż ich naturalnym środowiskiem jest woda może być znacznym hamulcem dla ich stosowania na skalę przemysłową. A może enzymy posiadają jeszcze jakieś wyjątkowe cechy, powodujące, że przemysł zainteresowany jest coraz szerszym ich zastosowaniem?
Autor: Bartłomiej Koźniewski
Literatura:
1. Jeremy M. Berg, Lubert Stryer, John L. Tymoczko: Biochemia. Warszawa: Wydawnictwo Naukowe PWN, 2007. ISBN 978-83-01-14379-4 .
2. Robert Kincaid Murray, Daryl K. Granner, Victor W. Rodwell: Biochemia Harpera ilustrowana. Warszawa: Wydawnictwo Lekarskie PZWL, 2008. ISBN 978-83-200-3963-4.
3. Charles M. Grisham, Reginald H. Garrett. Biochemistry. Filadelphia: Saunders College Publishing 1999 ISBN 0-03-022318-0.

