Koordynacja rozwoju rośliny z dostępnością składników odżywczych, takich jak rozpuszczalne cukry, ma istotne znaczenie w zapewnieniu wystarczającego zaopatrzenia w materiały budulcowe i energię. Ich poziomy regulują procesy rozwojowe począwszy od etapu zarodka aż do starzenia się organizmu roślinnego. Najważniejszymi cząstkami sygnalnymi są glukoza i sacharoza.
Sacharoza to nieredukujący disacharyd występujący u organizmów fotosyntetyzujących i cyjanobakterii. Jest główną formą transportu cukrów u roślin. Służy również jako materiał zapasowy. Eksport sacharozy z aktywnych fotosyntetycznie komórek mezofilu liścia, łączy to źródło asymilacji węgla (ang. source organ) z miejscem zapotrzebowania na węglowodany (ang. sink organ) – korzenie, owoce, nasiona, kwiaty, brodawki.
Rozszczepienie sacharozy jest dla roślin wielokomórkowych szczególnie ważne, ze względu na rozdzielenie kluczowych zasobów węgla i energii. Proces ten zapoczątkowuje tym samym wytworzenie sygnałów cukrowych (ang. sugar sensing and signaling) oddziałujących na ekspresję różnych genów i regulujących kolejne fazy rozwoju rośliny. Cukry zatem, poza funkcją odżywczą, pełnią również rolę cząstek sygnalnych.
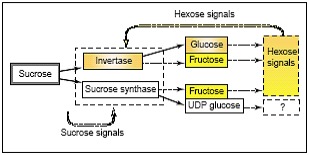
Rys. 1. Enzymy rozkładające sacharozę (syntaza sacharozy i inwertaza) oraz produkty katalizowanych przez nie reakcji – monosacharydy i sygnały cukrowe
Dodatkowe czynniki łączące metabolizm sacharozy z sygnałami cukrowymi, wiążą się ze szlakiem jej importu z liści – donorów (organów source) do akceptorów – organów sink, oraz z miejscami, gdzie ulega rozszczepieniu. Sacharoza wędrować może z floemu do importującej ją struktury sink, drogą symplastyczną – poprzez plasmodesmy, lub drogą apoplastyczną – przez ścianę komórkową z udziałem transporterów heksoz. Sacharoza może zostać rozłożona w wyniku działania kilku izoform inwertaz, zlokalizowanych w różnych kompartmentach komórki. Są to: inwertaza ściany komórkowej (cell wall invertase; CWIN), inwertaza cytoplazmatyczna (cytoplasmic invertase; CIN), inwertaza wakuolarna (vacuolar invertase; VIN). Syntaza sacharozy (sucrose synthase; SUS), rozszczepia sacharozę na terenie cytoplazmy. Jedynie połowa produktów katalizowanej przez ten enzym reakcji to wolne heksozy. Dodatkowo generalnie niska aktywność CIN, przyczyniają się do wytworzenia niewielkich ilości glukozy i fruktozy na terenie cytoplazmy. Przeciwnie, jeśli sacharoza wchodzi przez przestrzeń ściany komórkowej, może dzięki aktywności CWIN generować znaczne ilości heksoz. Szlaki metaboliczne sacharozy przebiegające przy udziale różnych form inwertaz przedstawia rys.2.
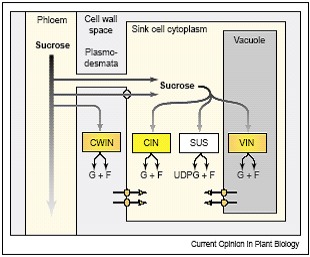
Rys.2. Drogi wejścia sacharozy do wnętrza komórki oraz miejsca jej rozszczepienia. CWIN-inwertaza ściany komórkowej; CIN-inwertaza cytoplazmatyczna; SUS-syntaza sacharozy; VIN-inwertaza wakuolarna; F-fruktoza; G-glukoza; UDPG-UDP-glukoza
Wolne heksozy – glukoza i fruktoza, inicjują następnie sygnały heksozowe, zarówno w błonie, jak i podczas dalszego metabolizmu w cytoplazmie. Podobnie, obfite ilości heksoz i sygnałów na nich opartych, mogą powstać w wakuoli za sprawą VIN. Widać zatem etapowość degradacji sacharozy. Już na samym wejściu do komórki typu sink istnieje wysoka aktywność inwertaz, a każde kolejne jej przedziały katabolizują pozostałą jeszcze ilość sacharozy.
Istnieje hipoteza dotycząca kontroli stosunku aktywności inwertazy względem syntazy sacharozy w kolejnych stadiach rozwojowych rośliny zakładająca, że inwertazy pośredniczą w początkowych etapach rozwoju związanych z zapoczątkowaniem potrzeb struktur sink (np. suche nasiona). Najpierw aktywne są VIN, później CWIN. Przejście do faz magazynowania i dojrzewania wiąże się ze wzmożoną aktywnością SUS. Jednakże w pewnych rejonach już podczas dojrzewania nadal podniesione są poziomy CWIN, a SUS może być aktywna podczas wczesnych etapów np. w miejscach szybkiego składania ściany komórkowej. Uogólniając, można powiedzieć, że heksozy kontrolują podział, wzrost i metabolizm, a sacharoza reguluje różnicowanie, dojrzewanie i magazynowanie. Istnieją zatem rozmaite dowody popierające twierdzenie, że równowaga pomiędzy aktywnością inwertazy i syntazy sacharozy może zmieniać rozwój rośliny poprzez zróżnicowane oddziaływanie na systemy sygnałów cukrowych.
Udział „wyczuwania” sacharozy w procesach sygnałowych
Wiele genów indukowanych przez glukozę jest skutecznie aktywowanych również przez sacharozę, która jeszcze przed rozłożeniem interferuje z ekspresją genów zachodzącą pod wpływem cukrów. Istnieje zatem jej specyficzny szlak sygnałowy oddzielony od szlaku „wyczuwania” monosacharydów. Może ona np. hamować symporter proton-sacharoza będący głównym etapem systemu dystrybucji zasobów w roślinie. Sacharoza indukuje aktywność i ekspresję fruktozylotransferazy – głównego enzymu biosyntezy fruktanu w liściach jęczmienia. Jest on również efektywnie stymulowany przez trehalozę, nawet w obecności silnego inhibitora trehalazy – Vox, dowodząc, że dwucukier ten działa nie tylko po degradacji do glukozy. Glukoza i fruktoza mają dużo słabszy wpływ na indukcję fruktozylotransferazy niż trehaloza, co jest kolejnym dowodem potwierdzającym, że „wyczuwanie” sacharozy, czy też innych disacharydów, jest niezależne od percepcji heksoz.
Innym przykładem jest hamowanie indukowanej przez kwas giberelinowy ekspresji alfa-amylazy jęczmienia przez glukozę, oraz disacharydy, takie jak sacharoza, laktuloza, palatinoza, turanoza. Spośród nich, jedynie glukoza destabilizuje mRNA alfa-amylazy, pozostałe cukry nie mają żadnego wpływu. Najprawdopodobniej „wyczuwanie” ich jest inne niż glukozy.
Uważa się, że kinazy SnRKs (ang. Snf1-related protein kinases) mogą uczestniczyć w mechanizmie pozwalającym na odmienne odpowiedzi rośliny na sacharozę i glukozę. Jest to możliwe ze względu na fakt, że są one indukowane przez wysokie stężenia sacharozy, a niskie glukozy.
Kontrola rozwoju roślin przez cukry
Cukry regulują następujące etapy rozwoju roślin:
– embriogeneza – glukoza promuje podział komórki, a sacharoza jej rozrost oraz depozycję zapasów w liścieniach roślin strączkowych;
– kiełkowanie nasion – glukoza opóźnia kiełkowanie nasion Arabidopsis, ale pozwala im kiełkować w obecności hamujących je stężeń ABA;
– rozwój siewek – wysokie stężenia glukozy i sacharozy, jak też niskie mannozy, hamują rozwój liścieni, tworzenie właściwych liści i wzrost młodych korzeni siewek Arabidopsis;
– tworzenie liści – podwyższone poziomy CO2, podnoszące przypuszczalnie produkcję cukrów, mogą indukować tworzenie większych i grubszych liści;
– wzrost brodawek – sacharoza łagodzi negatywny wpływ azotanu na szybkość wzrostu brodawek soi;
– tworzenie bulw – podwyższone stężenie sacharozy może spowodować tworzenie większej liczby bulw przez ziemniaki;
– przejście z fazy młodocianej (juwenilnej) do fazy dojrzałej – egzogenna glukoza przedłuża juwenilną fazę wzrostu mchu Physcomitrella patens; rośliny ze znokautowanym genem cykliny D nie wykazują takiej reakcji, co wskazuje na udział tej cykliny w integracji metabolizmu i rozwoju;
– kwitnienie – zwiększone poziomy sacharozy wspierają indukcję kwitnienia; egzogenna sacharoza pozwala Arabidopsis zakwitnąć nawet w kompletnej ciemności; zakwitnięcie tej rośliny wymaga aktywności syntazy trehalozo-6-fosforanu;
– starzenie się – glukoza w połączeniu z niskim poziomem azotu stymuluje starzenie się rośliny; proces ten jest więc regulowany nie tyle przez sam cukier, co przez stosunek węgiel:azot.
„Wyczuwanie” proporcji poziomów węgiel : azot
Zdolność wyczuwania metabolitów węglowych, jak również azotowych, pozwala roślinie regulować metabolizm i rozwój względem wewnętrznego stosunku węgiel:azot. Posiadanie mechanizmu „sugar-sensing” umożliwia „wyłączenie” fotosyntezy gdy ilość szkieletów węglowych jest dostatecznie duża. „Wyczuwanie” azotu daje możliwość zaprzestania poboru i redukcji azotanu kiedy poziomy zredukowanego lub organicznego azotu (amoniak, glutamina) są wysokie. Percepcja poziomów węgiel:azot umożliwia aktywację genów zaangażowanych w asymilację azotu gdy szkielety węglowe są liczne a wewnętrzne poziomy organicznego azotu są niskie. Może ona też warunkować zatrzymanie asymilacji azotu kiedy poziomy fotoasymilatów są niskie, a azotu wysokie. Mechanizmy te pozwalają na wydajne wykorzystywanie lub przechowywanie energii potrzebnej do napędzania transportu oraz metabolizmu węgla i azotu. Ich metabolity mogą służyć również jako sygnały integrujące stan środowiska zewnętrznego np. warunki świetlne, z wewnętrznymi regulatorami takimi jak fitohormony.
Wykazano, że odpowiedzi na pewne cukry zależą od poziomu azotu i odwrotnie. Geny kodujące transportery azotanu, reduktazę azotanową (NR), syntazę asparaginy (ASN), syntetazę glutaminy (GS) aktywowane są przez cukry. Innym poziomem interakcji pomiędzy cukrami, a azotem jest regulacja aktywności enzymów. Roślinne SnRKs (ang. Snf1-related protein kinases) kontrolują metabolizm węgla i azotu, oddziałując zarówno z reduktazą azotanową, jak i z syntazą sacharozo-6-fosforanu.
„Wyczuwanie” azotu zdaje się regulować różne procesy fizjologiczne i rozwojowe rośliny, na poziomie transkrypcyjnym, jak i posttranskrypcyjnym. W regulacji ekspresji genów przez azotan ważna jest równowaga węgiel:azot. W przypadku kukurydzy silne sygnały pochodzące od azotanu wzmacniają ekspresję genów zaangażowanych w fotosyntezę, a w tytoniu indukują metabolizm kwasów organicznych, hamując metabolizm skrobi. Prawdopodobnie rośliny wyczuwają azotan jako sygnalizator stanu nieorganicznego azotu, a wywodzące się z azotanu metabolity (amoniak, glutaminian, glutamina) mogą służyć jako sygnały informujące o poziomie zredukowanego lub organicznego azotu. Transkrypcja genów, których produkty uczestniczą w transporcie azotanu jest przez ten związek aktywowana, zaś jego metabolity regulują ten proces negatywnie.
Udział regulatorowych białek 14-3-3 w metabolizmie węgla i azotu u roślin
Aktywność wielu enzymów cytoplazmy np. komórek liści, czuła jest na zmiany aktywności fotosyntetycznej rośliny. Dostawy cukrów generowanych podczas fotosyntezy nie są ciągłe, ponieważ maleją, a nawet zanikają w ciemności, czy w okresie zimowym, po zrzuceniu liści. Kiedy roślina fotosyntetyzuje, wysoka aktywność enzymów zwiększa przepływ węgla poprzez syntezę sacharozy, szlaki asymilacji azotanu, syntezę kwasów organicznych, dostarczając węgla i azotu do syntezy aminokwasów.
Z cytoplazmatycznymi enzymami uczestniczącymi w asymilacji oraz metabolizmie azotu i węgla oddziałują regulatorowe białka 14-3-3, mające duży wpływ na rozdział (ang. partitioning) metabolitów w roślinie. Jest to wysoko zachowawcza rodzina eukariotycznych białek regulatorowych. Arabidopsis posiada 13 kodujących je genów. Białka te występują w różnych tkankach i kompartmentach komórek roślinnych tj. w jądrze, mitochondriach, chloroplastach, cytoplazmie. Białka 14-3-3, łącząc się (poprzez koniec C-terminalny) do motywów zawierających ufosforylowaną resztę seryny, zwiększają lub zmniejszają aktywność i kontrolują lokalizację oraz interakcje składników szlaków sygnałowych. Są to m.in. reduktaza azotanowa (NR), syntetaza glutaminy (GS), syntaza sacharozo-6-fosforanu (SPS), syntaza trehalozo-6-fosforanu (TPS).
Jednym z poziomów regulacji NR – enzymu zależnego od NADH, katalizującego redukcję azotanu do azotynu, jest fosforylacja seryny w pozycji 543. Reduktaza azotanowa odpowiada na zmianę światło/ciemność oraz aktywność fotosyntetyczną rośliny poprzez fosforylację, która warunkuje inaktywację enzymu w ciemności co gwarantuje, że toksyczny azotyn nie będzie produkowany w warunkach, kiedy nie będzie mógł ulec dalszej redukcji. Enzym ten katalizuje również produkcję NO w odpowiedzi na atak patogena. Fosforylacja NR nie jest wystarczająca do całkowitej inhibicji aktywności enzymu. Wymaga to dodatkowego połączenia z białkami 14-3-3 w obecności dwuwartościowych kationów. Oddziaływanie to hamuje przepływ elektronów pomiędzy domenami hemu a kofaktora, zmieniając konformację NR. Istnieje model zakładający, że NR zasocjowana z białkami 14-3-3 jest nadal aktywna, ale może ulec proteolizie z powodu niestabilności. Inhibicja ta może zostać zniesiona przez usunięcie białek 14-3-3 i defosforylację enzymu.
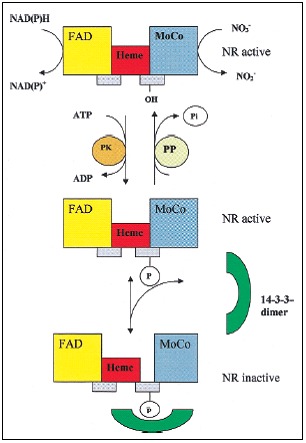
Rys.3. Regulacja aktywności reduktazy nitrogenazowej przez białka 14-3-3
Występująca w cytoplazmie i plastydach syntetaza glutaminy (GS), katalizuje zależną od ATP kondensację NH3 z glutaminianem. Białka 14-3-3 są tu aktywatorami formy cytoplazmatycznej enzymu. Stan fosforylacji GS zmienia się podczas przejścia światło-ciemność, a in vitro zależy od stosunku ATP/AMP. Defosforylacja sprzyja degradacji enzymu. Forma ufosforylowana oddziałuje z białkami 14-3-3.
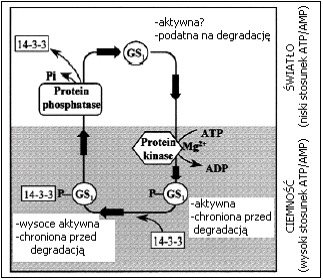
Rys.4. Model odwracalnej kontroli aktywności cytoplazmatycznej syntetazy glutaminy (GS1) przez fosforylację i defosforylację oraz udział białek 14-3-3
Odwracalna fosforylacja w odpowiedzi na zmianę światło/ciemność oraz stres osmotyczny występuje również w przypadku SPS. Białka 14-3-3 mogą asocjować w obecności Mg2+ z SPS hamując jej aktywność. Istnieje możliwość, że są także platformą pośredniczącą w jej interakcjach z innymi białkami. Stąd wynika rola białek 14-3-3 w regulacji metabolizmu cukrów.
Roślinne białka 14-3-3 oddziałują również z błonową H+– ATPazą, z syntazą skrobi III – regulując prawdopodobnie akumulację skrobi. Łączą się też do białek pośredniczących w indukcji ekspresji genów przez ABA.
W braku metabolizowalnych cukrów, połączenia z białkami 14-3-3 zostają utracone, co powoduje proteolizę ich partnerów przez specyficzne proteazy cysternowe, pociągając za sobą spadek asymilacji azotu oraz syntezy cukrów. Uczestniczą zatem w szlaku wyczuwania składników odżywczych kontrolując rozkład łączonych białek, oddziałując przez to na rozwój rośliny.
Oddziaływania białek 14-3-3 z syntetazą trehalozo-6-fosforanu podkreślają rolę trehalozo-6-fosforanu w warunkach stresu, np. głodu węglowego, ponieważ zerwanie połączeń białek 14-3-3 z tym enzymem może w warunkach niskich dostaw węgla wyłączać go z kompleksu enzymów syntetyzujących trehalozę. Sprawowana przez białka 14-3-3 regulacja metabolizmu, bardzo czuła jest także w stosunku do bodźców hormonalnych. Ich nadekspresja wiąże się ze zwiększeniem szans przeżycia komórek i z opóźnieniem starzenia się.
Cukry i azot a fitohormony
Wiele procesów związanych z rozwojem rośliny, regulowanych jest przez dostępność składników odżywczych gł. glukozy i sacharozy. W regulacji embriogenezy, kiełkowania, wczesnego rozwoju siewek, tworzenia bulw (tuberyzacja) oraz aktywności alfa-amylazy uczestniczą również fitohormony. Cukry pomagają w syntezie, sprzęganiu (ang. conjugation), i/lub transporcie hormonów roślinnych np. giberelin, ABA, a te uczestniczą w regulacji ich metabolizmu i/lub transportu. Węglowodany regulują ekspresję składników szlaków odpowiedzi na fitohormony i odwrotnie. Interakcje (ang. „cross-talk”) pomiędzy szlakami odpowiedzi na cukry i fitohormony mogą polegać na bezpośrednim oddziaływaniu składników jednego z nich na składniki innego, poprzez tworzenie kompleksów, lub pośrednim, na zasadzie zmieniania poziomów wtórnych przekaźników.
Wiele genów indukowanych stresem, ABA, kwasem jasmonowym, podlega koregulacji przez cukry. Regulują one również ekspresję genów lipooksygenazy (LOX) i białek PR (ang. pathogenesis-related proteins). Glukoza aktywuje biosyntezę i „wyczuwanie” ABA, co może być potrzebne do zależnej od heksokinazy (HXK) percepcji sygnałów cukrowych, hamuje zaś wyczuwanie etylenu.
Ekspresja wielu genów alfa-amylazy jest hamowana przez rozpuszczalne cukry np. glukozę i sacharozę. Stanowi to mechanizm regulujący rozkład skrobi tak, by ilość tych cukrów była wystarczająca. Transkrypcja alfa-amylazy tytoniu indukowana jest przez ABA, a alfa-amylazy ryżu hamowana przez glukozę. Gibereliny w przeciwieństwie do ABA indukują ekspresję niektórych genów alfa-amylazy. Regulacyjne działanie cukrów zależy od ich stężenia i ma miejsce na poziomie transkrypcyjnym i posttranskrypcyjnym.
Szlaki sygnałowe cukrów i hormonów mogą się różnie łączyć zależnie od ich stężenia, typu komórki/tkanki, fazy rozwojowej, stanu fizjologicznego, warunków środowiska.
Działanie sygnałowe hormonów oddziałuje nie tylko z wyczuwaniem cukrów, ale również azotu. Przypuszcza się, że u kukurydzy i Arabidopsis cytokininy są sygnałem wędrującym z korzeni do liści, który informuje o dostępności azotu, regulując ekspresję reagujących na niego genów. Sieć transdukcji sygnałów (ang. „cross-talk”), integrująca metabolizm węglowodanów i asymilację azotu, podlega regulacji przez fitohormony. Przypuszcza się, że w skoordynowanym „wyczuwaniu” sacharozy, glukozy i azotanu uczestniczy ABA i dwa białka odbierające sygnały pochodzące od ABA – ABI4 i ABI5. Poza wspomnianymi wyżej cytokininami i ABA, w integrowaniu sygnałów azotanowych na poziomie całej rośliny uczestniczą również auksyny.
Marta Muszyńska
Literatura:
1. Andersen M.N., Asch F., Wu Y., Jensen C.R., Naested H., Mogensen V.O., Koch K.E. (2002) „Soluble invertase expression is an early target of droughtstress during the critical, abortion-sensitive phase of young ovary development in maize” Plant Physiol 130:591-604
2. Bachmann M., Huber J.L., Athwall G.S., Wu K., Ferl R.J., Huber S.C. (1996) „14-3-3 proteins associate with the regulatory phosphorylation site of spinach jeaf nitrate reductase in an isoform-specific manner and reduce dephosphorylation of Ser-543 by endogenous protein phosphatases” FEBS Letters 398:26-30
3. Bachmann M., Huber J.L., Liao P.-C., Gabe D.A., Huber S.C. (1996) „The inhibitor of phosphorylated nitrate reductase from spinach (Spinacia oleracea) leaves is a 14-3-3 protein” FEBS Letters 387:127-131
4. Bethke P.C., Schuurink R., Jones R.L. (1997) „Hormonal signalling in cereal aleurone” J. Exp. Bot. 48:1337-1356
5. Coruzzi G.M., Zhou L. (2001) „Carbon and nitrogen sensing and signaling in plants: emerging ,matrix effects,” Current Opinion in Plant Biology 4:247-253
6. Cotelle V., Meek S.E.M., Provan F., Milne F.C., Morrice N., MacKintosh C. (2000) „14-3-3s regulate global cleavage of their diverse binding partners in sugar-starved Arabidopsis cells” The EMBO Journal 19/12:2869-2876
7. Börnke F. (2005) „The variable C-terminus of 14-3-3 proteins mediates isoform-specific interaction with sucrose-phosphate synthase in the yeast two-hybrid system” Journal of Plant Physiology 162:161-168
8. Finnemann J., Schjoerring J.K. (2000) „Post-translational regulation of cytosolic glutamine synthetase by reversible phosphorylation and 14-3-3 protein interaction” The Plant Journal 24(2):171-181
9. Gibson S.I. (2004) „Sugar and phytohormone response pathways: navigating a signalling network” Journal of Experimental Botany 55/395:55108-1095
10. Ferl R. (2004) „14-3-3 proteins: regulation of signal-induced events” Physiologia Plantarum 120:173-178
11. Foyer C.H., Parry M., NoctorG. (2003) „Markers and signals associated with nitrogen assimilation in higher plants” Journal of Experimental Botany 54/382:585-593
12. Fu H., Subramanian R.R., Masters S.C. (2000) „14-3-3 PROTEINS: Structure, Function, and Regulation” Annu. Rev. Pharmacol. Toxicol. 40:617-47
13. Gibson S.I. (2005) „Control of plant development and gene expression by sugar signaling” Current Opinion in Plant Biology 8:93-102
14. Kaiser W.M., Huber S.C. (2001) „Post-translational regulation of nitrate reductase: mechanism, physiological relevance and environmental triggers” Journal of Experimental Botany 52/363:1981-1989
15. Lanaham M.B., Ho T.-H.D., Rogers S.W., Rogers J.C. (1992) „A gibberellin response complex in cereal -amylase gene promoters” The Plant Cell 4:203-211
16. León P., Sheen J. {2003) „Sugar and hormone connections.” Trends in Plant Science 8/3:110-116
17. Koch K. (2004) „Sucrose metabolism: regulatory mechanisms and pivotal roles in sugar sensing and plant development” Current Opinion in Plant Biology 7:235-246
18. Loreti E., Alpi A., Perata P. (2000) „Glucose and Disaccharide-Sensing Mechanisms Modulate the Expression of -amylase in Barley Embryos” Plant Physiology 123:939-948
19. Moorhead G., Douglas P., Cotelle V., Harthill M., Scarabel M., Aitken A., MacKintosh C. (1999) „Phosphorylation-dependent interactions between enzymes of plant metabolism and 14-3-3 proteins” The Plant Journal 18(1):1-12
20. Müller J., Wiemken A., Aeschbacher R. (1999) „Trehalose metabolism in sugar sensing and development” Plant Science 147:37-47
21. Nguyen-Quoc B., Foyer C. (2001) „A role for 'futile cycles’ involving invertase and sucrose synthase in sucrose metabolism of tomato fruit” Journal of Experimental Botany 52/358:881-889
22. Roitsch T., GonzálezM-C. (2004) „Function and regulation of plant invertases: sweet sensations” Trends in Plant Science 9/12:1360-1385
23. Sehnke P.C., DeLille J.M., Ferl R.J. (2002) „Consummating Signal Transduction: The Role of 14-3-3- Proteins in the Completion of Signal-Induced Transitions in Protein Activity” The Plant Cell S339-S354
24. Sheen J., Zhou L., Jang J.-C. (1999) „Sugars as signaling molecules” Current Opinion in Plant Biology 2:410-418
25. Rolland F., Moore B., Sheen J. (2002) „Sugar Sensing and Signaling in Plants” The Plant Cell S185-S205
26. Sturm A., Tang G.-Q. (1999) „The sucrose-cleaving enzymes of plants are crucial for development, growth and carbon partitioning” Trends Plant Sci 4:401-407
27. Toroser D., Athwal G.S., Huber S.C. (1998) „Site-specific regulatory interaction between spinach leaf sucrose-phosphate synthase and 14-3-3 proteins” FEBS Letters 435:110-114
28. Van Ghelue M., Ribeiro A., Solheim B., Akkermans A.D.L., Bisseling T., Pawlowski K. (1996) „Sucrose synthase and enolase expression in actinorhizal nodules of Alnus glutinosa: comparison with legume nodules” Mol Gen Genet 50:437-446
29. Vargas W., Cumino A., Salerno G.L. (2003) „Cyanobacterial alkaline/neutral invertases. Origin of sucrose hydrolysis in the plant cytosol?” Planta 216:951-960
30. Wu G-L., Zhang X-Y., Zhang L-Y., Pan Q-H., Shen Y-Y., Zhang D-P. (2004) „Phloem Unloading in Developing Walnut Fruit is Symplasmic in the Seed Pericarp and Apoplasmic in the Fleshy Pericarp” Plant Cell Physiol 45(10):1461-1470

