Herpeswirusy są jednymi z najbardziej rozpowszechnionych patogenów człowieka. Przyjmują postać ikosaedralnego (dwudziestościennego) kapsydu z wirusowym DNA we wnętrzu. Sam nukleokapsyd osiąga średnicę około 100 nm, a wirion wraz z osłonką od 120 do 200 nm. Z zewnątrz herpeswirusy otoczone są charakterystyczną strukturą, określaną jako tegument, wokół której znajduje się otoczka z błony lipidowo-białkowej z wystającymi białkami umożliwiającymi wnikanie do atakowanych komórek jak również stanowiącymi główny cel przeciwciał neutralizujących.
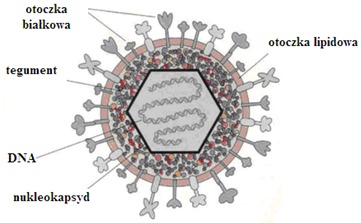
Rys.1 Budowa herpeswirusów (5)
Taksonomia herpeswirusów
Herpeswirusy są jedną z największych rodzin wirusowych. Jak dotąd zidentyfikowano ponad dwieście przedstawicieli należących do tej grupy. W taksonomii herpeswirusów wyróżniamy trzy podrodziny: Alphaherpesvirinae, Betaherpesvirinae, Gammaherpesvirinae. Herpeswirusy patogenne dla człowieka reprezentują wszystkie trzy podrodziny Herpesviridae. Do pierwszej podrodziny zaliczamy m.in. HSV-1 i HSV-2 (wirusy opryszczki pospolitej) oraz HHV-3 (wirus ospy wietrznej i półpaśca VZV). Podrodzinę Betaherpesvirinae reprezentują ludzki cytomegalowirus HCMV (HHV-5) oraz wirusy rumienia nagłego HHV-6 i HHV-7. Przedstawicielami Gammaherpesvirinae są natomiast wirus Epsteina-Barr (HHV-4) oraz wirus mięsaka Kaposiego KSHV (HHV-8).
Patogenność i chorobotwórczość herpeswirusów
Ludzkie herpeswirusy powodują u osób z prawidłowo funkcjonującym układem immunologicznym choroby zwykle o przebiegu łagodnym lub wręcz infekcje bezobjawowe. Groźne stają się wówczas, gdy zawodzi kontrola układu immunologicznego np. u osób z upośledzoną odpornością lub poddanych immunosupresji, u osób po transplantacjach czy chorych z HIV/AIDS. Ponadto EBV i KSHV to wirusy onkogenne, a EBV jest jednym z najczęstszych wirusowych czynników etiologicznych nowotworów człowieka.
Herpeswirusy na zasadzie fuzji łączą się z receptorami błony plazmatycznej, na powierzchni komórki. Następnie nukleokapsyd wirusa przez cytoplazmę dostaje się do jądra komórki, co zapoczątkowuje proces syntezy RNA. Najwcześniej zachodzi bezpośrednia synteza wczesnego mRNA (αRNA) , gdyż do jego ekspresji nie jest wymagana wcześniejsza synteza wirusowych białek ani DNA. Następuje także ekspresja wczesnego RNA (βRNA), która wymaga syntezy białek bezpośrednio wczesnych, ale nie wymaga syntezy wirusowego DNA. Oba rodzaje RNA są z kolei przepisywane przez komórkową polimerazę II. Ekspresja późnego RNA (γRNA) wymaga syntezy zarówno bezpośrednio wczesnych, jak i wczesnych białek, a także syntezy wirusowego DNA. Zsyntetyzowany mRNA przechodzi do cytoplazmy, gdzie podlega translacji przy udziale systemu komórkowego. Nowo zsyntetyzowane białka wirusowe podlegają potranslacyjnym przemianom. W jądrze powstają nukleokapsydy, pączkujące przez błonę jądrową, które są następnie uwalniane z komórki. Czas replikacji wirusa jest różny, np. dla HSV wynosi około 24 godzin, a dla cytomegalii około 96 godzin. Ważną i wspólną cechą wszystkich herpeswirusów jest zdolność do wywoływania zakażeń utajonych (latentnych), które mogą następnie ulegać reaktywacji. Wirusy te mają zdolność przetrwania w ustroju człowieka w różnych komórkach np. HSV i VZV w zwojach nerwów czuciowych, EBV w komórkach nabłonkowych jamy ciała zaś CMV w komórkach nabłonkowych gruczołów ślinowych i komórkach kanalików nerkowych. Podczas latencji zachodzi ograniczona ekspresja genów, głównie potrzebnych do zahamowania cyklu litycznego, nie wykrywa się również produktów białkowych (HSV) lub ich liczba jest ograniczona Następnie pod wpływem określonych czynników wirusy te mogą ulec okresowej reaktywacji. Czynnikami predysponującymi do reaktywacji zakażenia mogą być: immunosupresja, zaburzenia hormonalne, promieniowanie UV, czynniki stresogenne jak również infekcje wywołane przez inne drobnoustroje.
Szczepionki przeciwko herpeswirusom
Przedstawiciele rodziny Herpesviridae należą do najbardziej rozpowszechnionych patogenów wirusowych w naszej populacji. Częstość zakażeń herpeswirusowych wzrasta z roku na rok pomimo istnienia skutecznych chemioterapeutyków. Infekcje herpeswirusowe kontroluje się przy pomocy takich środków leczniczych jak analogi nukleozydowe (acyklowir, gancyklowir, famcyklowir, walacyklowir) lub nukleotydowe (cidofowir). Jednakże nie doprowadziło to do całkowitej eradykacji wirusów z populacji, głównie ze względu na symptomatyczne wydalanie wirusów oraz zdolność herpeswirusów do przebywania w stanie latencji i cyklicznych reaktywacji. Dlatego uzasadniony wydaje się pogląd, iż do eradykacji herpeswirusów mogą się przyczynić przede wszystkim szczepionki, jako uzupełnienie stosowania leków. Pomimo wieloletnich badań komercyjnie dostępne są jedynie szczepionki dla wirusa ospy wietrznej i półpaśca, której podstawę stanowi ten sam żywy atenuowany szczep wirusa Oka wyizolowany w 1974 roku w Japonii, od dziecka przechodzącego pełnoobjawową ospę wietrzną. Opracowanie skutecznych szczepionek przeciw pozostałym głównym herpeswirusowym patogenom człowieka takim jak wirus CMV, EBV i HSV-2 znajduje się na liście celów priorytetowych. Jednakże na chwilę obecną szczepionki te są w różnych fazach badan klinicznych. Równolegle z rozwojem szczepionek przeciw herpeswirusom testowane są różne podejścia mające na celu konstrukcję wektorów herpeswirusowych. Wektory oparte na wirusie HSV są bardzo obiecującymi kandydatami w terapii wirusowej głównie chorób o podłożu neurologicznym oraz nowotworów. Obecnie konstruuje się kilka różnych wektorów (amplikonowe, defektywne, HSV atenuowane) w zależności od zdolności replikacyjnych wirusa. Ponadto dzięki nowym metodom biologii molekularnej, które mają swoje zastosowanie w optymalizacji produkcji wektorów wirusowych, zwiększa się ich bezpieczeństwo, co skutkuje testami wektorów w terapii coraz to nowych rodzajów nowotworów.
Autor: Beata Rola
Literatura:
1) Lipińska A., Bieńkowska-Szewczyk K. 2010. „Nowe szczepionki przeciw herpeswirusom i wektory herpeswirusowe w terapii człowieka” Post. Mikrobiol, 3: 199-207
2) Działo J., Deptuła W. 2010. „Systematyka wirusów kręgowców — aktualne dane” Kosmos, 59:435-449
3) Watanabe D. 2010. “ Medical application of herpes simplex virus”. J. Derm. Sci. 57, 75-82
4) Arvin A.M., Gershon A.A. 1996. “Live attenuated varicella vaccine” Annu. Rev.Microbiol. 50: 59-100
5) http://medicaltrue.com/wp-content/uploads/2011/07/herpes-virus.jpg

