Degradacja środowiska jest głównym czynnikiem wpływającym na kondycję ludzi zamieszkujących tereny antropogeniczne. Ekspozycja na metale ciężkie w miejscu zamieszkania i destabilizacja gospodarki biopierwiastkami, są powszechnym źródłem stresu środowiskowego. Reakcje organizmu na stresory zewnętrzne i wewnętrzne (fizjologiczne) mają podłoże warunkowane czynnikami środowiskowymi (makroelementy, mikroelementy, toksyczne metale ciężkie). Wiążą się one z wpływem zanieczyszczeń środowiska na sprawność enzymatycznych mechanizmów antyoksydacyjnych tj: SOD, CAT, CP, GSH itd.
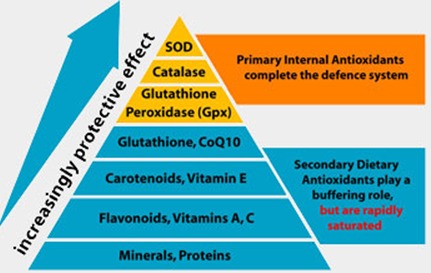
Rys. Piramida wyższości enzymów antyoksydacyjnych.
Enzymatyczne mechanizmy antyoksydacyjne
• Dysmutazy ponadtlenkowe (SOD),
• Katalazy (CAT),
• Ceruloplazminy (CP)
• Glutation (GSH) – w formie zredukowanej: reduktaza glutationowa (GR)
• Glutation (GSH) – w formie utlenione: peroksydaza glutationowa (GPx)
a) SODM
Rodzina dysmutaz ponadtlenkowych jest składnikiem zarówno komórkowego jak i pozakomórkowego systemu antyoksydacyjnego. Enzymy należące do tej grupy to metaloenzymy.
U człowieka wyróżniamy 3 rodzaje enzymów SOD:
– cynkowo-miedzianowa dysmutaza ponadtlenkowa (Cu-Zn SOD,SOD1) : wewnątrzkomórkowa
– manganowa dysmutaza ponadtlenkowa (Mn SOD,SOD2): wewnątrzkomórkowa
– dysmutaza ponadtlenkowa (EC-SOD,SOD3): zewnątrzkomórkowa
Enzymy te katalizują reakcję przekształcenia anionorodnika ponadtlenkowego do nadtlenku wodoru i tlenu cząsteczkowego w dwuetapowej reakcji.
• SOD-Men+ + O2.- → SOD-Me (n-1) + O2
Redukcja jonu metalu z jednoczesnym uwolnieniem cząsteczki tlenu.
• SOD-Me(n-1)+ + O2.- + 2H+ → SOD-Men+ + H2O2
Utlenienie jonu metalu przy udziale anionorodnika ponadtlenkowego i wodoru z jednoczesnym wytworzeniem nadtlenku wodoru.
b) CAT
Enzym katalaza uczestniczy w enzymatycznej obronie organizmu przed wolnymi rodnikami. Katalizuje reakcję redukcji nadtlenku wodoru, prowadzącą do powstania tlenu cząsteczkowego i wody.
• H2O2 + Fe(III)-CAT → 2 H2O +O+ Fe(V)-CAT
Redukcja nadtlenku wodoru do H2O, uczestniczy jon żelaza Fe(III) ukł. Hemowego, w wyniku reakcji powstaje Fe(V)-CAT.
• H2O2 + O-Fe(V)-CAT → Fe(III)- CAT + H2O + O2
Reakcja utlenienia z udziałem Fe(V)-CAT kolejnej cząsteczki nadtlenku wodoru, w wyniku której powstaje O2 i H2O.
Katalaza organizmów eukariotycznych jest homotetramerem. W każdej podjednostce jest osadzony układ hemowy z położonym centralnie atomem żelaza, związanym w miejscu aktywnym 5 wiązaniami koordynacyjnymi.
Głównym miejscem występowaniem enzymu CAT są: peroksysomy, mitochondria, retikulum endoplazma tyczne, komórki wątroby, szpiku.
c) GPx
Glutation w postaci utlenionej (peroksydaza glutationowa), uczestniczy w pierwszej i drugiej linii obrony przed wolnymi rodnikami. Chroni komórki przed powstającymi w procesie biochemicznym nadtlenkami. Peroksydaza glutationu jest metaloenzymem i bierze udział w redukcji nadtlenku wodoru z jednoczesnym przekształceniem zredukowanego glutationu w jego formę utlenioną. Enzym ten ma zdolność redukcji nadtlenków nieorganicznych (H2O2) i nadtlenków organicznych (ROOH) z wytworzeniem kwasu selenowego jako produkt pośredni.
• 2GSH + H2MO2 → GSSH + 2H2O2
• GSH + ROOH → RO-SG + H2O
• RO-SG +GSH → ROH + GSSG
Peroksydazy glutationowe (selenoperoksydazy) zawierają selen pod postacią selenocysteiny w miejscu aktywnym. Grupa selenoperoksydaz obejmuje 5 izoform:
– cytozolowa peroksydaza glutationowa (cGPx)
– żołądkowo-jelitowa peroksydaza glutationowa (GPOX-2)
– plazmatyczna peroksydaza glutationowa (pGPx)
– peroksydaza glutationowa wodoronadtlenków lipidów (phGPX)
– jądrowa peroksydaza glutationowa (spGPx)
d) GR
Glutation w postaci zredukowanej uczestniczy w drugiej linii obrony przed wolnymi rodnikami. Enzym ten występuje w cytozolu i mitochondriach, jest flawoproteiną, która jako czynniki redukujące wykorzystuje NADPH. Funkcje pełnione przez ten enzym to m.in.: utrzymywanie prawidłowego stężenia GSH w komórce dzięki zdolności do przekształcania GSSH w GSH. GR uczestniczy w przemianach detoksyfikujących tlen.
e) CP
Ceruloplazmina to białko wiążące jony miedzi. Ponadto usuwa ona anionorodniki ponadtlenkowe, chroni przed utlenieniem składników błony komórkowej. Ponad 95% miedzi w surowicy jest związanych ceruloplazminą. Zdolność wiązania miedzi wynosi 6-8 atomów na mol ceruloplazminy.
CP pełni 4 zasadnicze role w osoczu krwi:
– jako czynnik ograniczający uwalnianie zapasów żelaza,
– jako aktywator procesów oksydacji kwasu askorbinowego, serotoniny, nor epinefryny,
– jako zmiatacz rodników ponadtlenkowych.
Nieenzymatyczne mechanizmy antyoksydacyjne
• Kwas askorbinowy (witamina C)
• Tokoferol (witamina E)
• Retinol (witamina A)
a) Witamina C
Kwas askorbinowy to silny antyoksydant funkcjonujący w środowisku wodnym jako pojedynczy przeciwutleniacz. W płynach ustrojowych w warunkach fizjologicznych występuje w 99% jako anion askorbinowy, jedynie 0,05% jako niezjonizowany kwas. Funkcje jaką pełni witamina C to:
– zdolność odwracalnego utleniania i redukcji, dzięki czemu utrzymuje prawidłowy stan erdoks komórki,
– redukuje reaktywne formy tlenu tj: anionorodnik ponadtlenkowy, rodnik hydroksylawy,
– posiada aktywność pro oksydacyjną, która jest związana ze zdolnością tej witaminy do inter-akcji z jonem metali przejściowych, tj. jon żelaza i jon miedzi.
b) Witamina E
Tokoferol α ma największą aktywność biologiczną w błonach komórkowych i lipoproteinach osocza. Dzięki 16-węglowemu łańcuchowi może wbudować się do struktury błony komórkowej chroniąc przed uszkodzeniami oksydacyjnymi.
Antyoksydacyjne właściwości witaminy E polegają na usuwaniu wtórnych rodników, produktów rodnikowych peroksydacji lipidów. Produkty reakcji witaminy E z rodnikami nadtlenków lipidów to mniej reaktywne rodniki tokoferolowe. Te wolnorodnikowe pochodne tokoferolu wpływają na proces utlenienia lipidów reagując z rodnikiem nadtlenkowym lub z rodnikiem tokoferylowym.
Rodnik tokoferylowy może zostać usunięty przez inne antyoksydanty, tj: glutation czy witamina C.
c) Witamina A
Witamina A to antyoksydant hydrofobowy, występuje w dwóch formach: jako retinol bądź 3,4-dihydroretinol. Główne miejsce występowania witaminy w/w to wątroba, tkanka tłuszczowa. Działanie antyoksydacyjne witaminy A, polega na reagowaniu z rodnikiem nadtlenkowym oraz na hamowaniu łańcucha reakcji wolnorodnikowych. Ma również zdolność do bezpośredniej reakcji z wolnymi rodnikami oraz wygaszanie tlenu singletowego.
Podsumowanie
Opisane enzymy odgrywają istotną rolę jako system obrony przed reaktywnymi formami tlenu (RFT). Chronią zarówno komórki, jak i obszary pozakomórkowe przed szkodliwym działaniem nadmiaru wolnych rodników powstających w patologicznych procesach, takich jak: zapalenie, niedokrwienie, reperfuzja, atak serca, udar czy procesy transplantacji narządów. Utrzymują one ponadto równowagę pro- i antyoksydacyjną w przypadku chorób, w których dochodzi do zwiększonego wytwarzania wolnych rodników.
Karolina Bombolewska
Literatura:
1. Bartosz G., 2003. Druga twarz tlenu, Wolne rodniki w przyrodzie. PWN.
2. Gałecka E., Mrowicka M., Malinowksa K., 2008. Wolne rodniki tlenu i azotu w fizjologii. Pol. Merk. Lek, 24: 446-448.
3. Ball S. W., 2001. Antyoksydanty w medycynie i zdrowiu człowieka. Medyk.
4. Van Loon G.W., Duffy S.J., 2007. Chemia środowiska. Wyd. Nauk. PWN.
5. Siemiński M., 2007. Środowiskowe zagrożenie zdrowia człowieka – nowe wyzwania. Wyd. Nauk. PWN.
6. Berg J.M., Tymoczko J.L., Stryer L., 2008. Biochemia. Wyd. Nauk. PWN.
7. Czarna M., Jarmuszkiewicz W., 2006. Rola mitochondriów w wytwarzaniu i usuwaniu reaktywnych form tlenu; związek z przesyłaniem sygnałów i programowaną śmiercią komórki. Postępy Biochemii, 52:145-155.
8. Karihtala P., Ylermi S., 2007. Reactive oxygen species and antioxidant mechanisms in human tissues and their relation to malignancies. APMIS, 115: 81-103.
9. Nakagawa Y. 2004. Role of mitochondrial phospholipid hydroperoxide glutathione peroxidase (PHGPx) as a antiapoptotic factor. Biol. Pharm. Bull., 27: 956-960.
10. www.ncbi.nlm.nih.gov
11. http://www.nature.com
12. http://lem.ch.unito.it

