Podstawową jednostką strukturalną organizmów żywych jest komórka. Wypełniająca ją cytoplazma różni się od środowiska zewnętrznego zarówno składem jak i stężeniem poszczególnych substancji. Dzięki białkowo-lipidowej błonie, komórka może prowadzić wymianę poszczególnych związków przy jednoczesnym zachowaniu swojej integralności. Zasada ta dotyczy również otoczonych błoną organelli, np. mitochondriów i chloroplastów.
Wymiana substancji prowadzi do zmian stężeń obu roztworów. Procesy zachodzące zgodnie z gradientem stężeń (tzn. od roztworu o wyższym stężeniu do roztworu o stężeniu niższym) nie wymagają nakładu energii i określane są mianem biernych. Procesy przebiegające w przeciwnym kierunku nazywa się transportem aktywnym substancji. Transport wbrew gradientowi wymaga nakładu energii oraz obecności specjalnych pompy napędzanych za pomocą ATP lub światła (energią fotonów). Zjawisko to dotyczy głownie jonów, które ze względu na swój ładunek elektryczny nie mogą samodzielnie przekraczać błony komórkowej. Transportujące je białka są bardzo selektywne.
Jednym z najlepiej poznanych mechanizmów aktywnego transportu jest zasada działania pompy sodowo-potasowej (Na+-K+), czyli integralnego białka błonowego, wykorzystującego energię z hydrolizy ATP do przemieszczania jonów wbrew gradientowi stężeń, tzn. Na+ na zewnątrz komórki, a K+ do jej środka. Jony Na+ i cząsteczka ATP przyłączają się do pompy. Hydroliza ATP powoduje zmianę struktury białka i transport jonów Na+ na drugą stronę błony, po której przyłączane są jony K+. Wtedy to następuje uwolnienie jonów Na+ i przetransportowanie jonów K+ na drugą stronę. W ten sposób pompa sodowo- potasowa wytwarza gradient jonowy. Pełni on w komórce bardzo ważną rolę, gdyż kontroluje jej objętość, warunkuje pobudzenie nerwów i mięśni oraz stanowi siłą napędową aktywnego transportu cukrów i aminokwasów.
Integralną częścią pompy jest enzym ATPaza Na+– K+ , odpowiedzialny za hydrolizę ATP i wytwarzanie energii niezbędnej do transportu kationów. Pompa składa się ponadto z dwóch rodzajów podjednostek: α (112kDa) i β (35 kDa), tworzących w błonie tetramer α2β2. Łańcuch α ma przynajmniej osiem helis transbłonowych, a jego duża część, łącznie z miejscem aktywnym ATPazy, umieszczona jest po cytozolowej stronie błony. Mała część łańcucha α eksponowana jest na zewnętrznej powierzchni błony komórkowej i zawiera miejsce wiążące inhibitory pompy – steroidy kardiotoniczne. Łańcuch β posiada pojedynczą transbłonową helisę i wydaje się być nieistotny zarówno dla aktywności ATPazy, jak i dla procesu transportu.
ATPaza Na+-K+ jest fosforyzowana przez ATP w obecności jonów Na+ i Mg2+. Miejscem fosforylacji jest boczny łańcuch specyficznej reszty asparginianu. Powstały intermediat β-aspartylofosforylowy jest hydrolizowany w obecności K+. Do reakcji fosforylacji nie są zatem potrzebne jony K+, a do defosforylacji nie jest wymagana obecność Na+ i Mg2+.
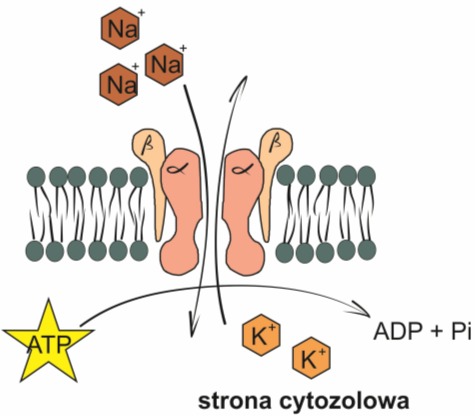
Rys. 1. Pompa sodowo-potasowa
Hydroliza ATP umożliwia zatem przemieszczanie się związków wbrew gradientowi ich stężenia. Jest to tak zwany pierwotny transport aktywny. Powstający dzięki temu rozkład jonów może zostać wykorzystany do transportu innych związków. Proces ten nazywa się wtórnym transportem aktywnym. Przykładem może być resorpcja glukozy w jelitach kosztem transportu Na+.
Wyróżnia się trzy typy transportu aktywnego:
• uniport – przemieszczanie jednego specyficznego typu molekuł w jednym kierunku (transport pierwotny);
• symport – polega na przemieszczeniu dwóch różnych substancji w tym samym kierunku. W niektórych wypadkach muszą być one związane jednocześnie (transport wtórny);
• antyport – transport dwóch różnych substancji w dwa różne kierunki (transport wtórny).
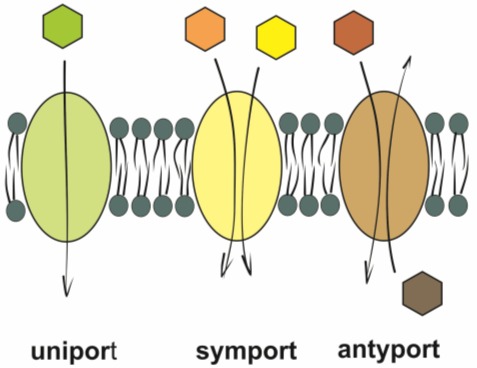
Rys. 2. Rodzaje transportu aktywnego
U bakterii występują dodatkowo specjalne pompy MDA, biorące udział w wydalaniu poza komórkę leków, toksyn, środków antyseptycznych i dezynfekcyjnych. Jest to tzw. mechanizm Efflux, oparty na obecności specjalnych błonowych białek transportowych wykorzystujących energię ATP lub zjawisko kotransportu jonów wodorowych. Pompy te cechuje duża swoistość substratowa. Ze względu na strukturę i funkcje dzieli się je na 5 klas:
• MFS (ang. major facilitator superfamily),
• SMR (ang. small multidrug resistance family),
• MaTE (ang. multidrug and toxic compound extrusion family),
• ABC (ang. ATP binding cassette superfamily),
• RND (ang. resistance nodulation cell division family).
Większe elementy mogą przemieszczać się do środka komórki na drodze endocytozy. Podczas tego procesu błona komórkowa otacza wybraną cząstkę, a następnie odrywa się i transportuje zamknięte wewnątrz związki. Łączenie się błon wymaga nakładu energii oraz obecności specjalnych białek występujących po obu stronach dwuwarstwy. U organizmów jednokomórkowych endocytoza stanowi sposób pozyskiwania pożywienia. U organizmów złożonych proces ten jest wykorzystywany jedynie przez wyspecjalizowane komórki, np. makrofagi.
Istnieje wiele typów endocytozy. W fagocytozie pęcherzyk łączy się z lizosomom, a zawarte wewnątrz niego elementy ulegają strawieniu. Podczas pinocytozy tworzący się pęcherzyk otacza wodę i zawarte w niej drobne substancje. Istnieje również endocytoza kierowana receptorami (endocytoza receptorowa), która umożliwia transport specyficznych związków, np. hormonów, czynników wzrostu, przeciwciał, enzymów, witamin. Występują one w otaczającym komórkę środowisku jedynie w bardzo małych stężeniach. Znajdujące się na zewnętrznej części błony białka receptorowe rozpoznają i wiążą molekuły o charakterystycznej strukturze inicjując w ten sposób proces endocytozy. Zjawisko to zostało bardzo dobrze opisane już w 1985 roku przez Michaela Browna i Josepha Goldsteina na przykładzie wychwytywania cholesterolu z krwi.
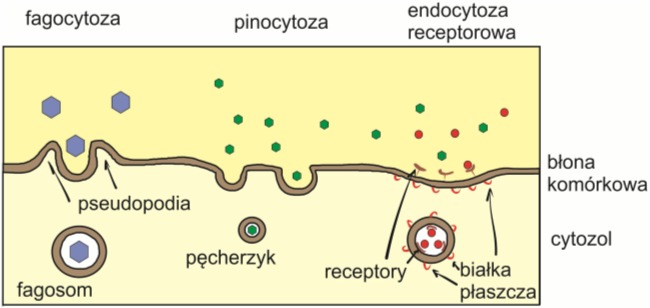
Rys. 3. Rodzaje endocytozy
Przeciwieństwem endocytozy jest egzocytoza. Może ona zachodzić w sposób ciągły lub być wywoływana zewnętrznym sygnałem. Substancje takie jak zbędne produkty przemiany materii transportowane są w pęcherzykach na zewnątrz komórki. Pęcherzyki łączą się następnie z błoną komórkową i otwierają wydalając zawarte wewnątrz substancje. Dotyczy to głównie białek pochodzących z retikulum endoplazmatycznego i Aparatu Golgiego. W ten sposób mogą być transportowane m. in. neurotransmitery, enzymy, hormony.
Autor: Anna Kurcek
Literatura:
• Lubert Stryer “Biochemia”, Wydawnictwo Naukowe PWN, Warszawa 2003;
• “Membrane Transport” 2010; http://mrwinch.files.wordpress.com/;
• Anna Wasążnik, Mariusz Grinholc, Krzysztof P. Bielawski „Czynne usuwanie leku z komórki jako jeden z mechanizmów odporności bakterii na środki przeciwdrobnoustrojowe i metody jego zwalczania”; Postepy Hig Med. Dosw. (online), 2009; 63:123-133;

