W 1996 roku prof. Pal Nyren oraz jego uczeń Mostafa Ronaghi z Royal Institute of Technology w Sztokholmie opracowali nową technikę sekwencjonowania DNA zwaną dziś pirosekwencjonowaniem, czyli sekwencjonowaniem w czasie rzeczywistym. Kolejność zasad azotowych w badanym fragmencie DNA odczytuje się w niej dzięki analizie błysków chemiluminescencji, emitowanych podczas dobudowywania kolejnych nukleotydów do jednoniciowej matrycy.
Zasada metody
Pierwszym krokiem do rozpoczęcia pirosekwencjonowania jest przygotowanie jednoniciowej matrycy za pomocą reakcji PCR (ang. Polymerase Chain Reaction, czyli łańcuchowa reakcja polimerazy) oraz jej oczyszczenie z nieprzyłączonych nukleotydów i starterów.
Następnie przeprowadza się hybrydyzację matrycy ze znakowanym biotyną primerem oraz inkubację z odpowiednimi enzymami (polimerazą DNA, sulfurylazą ATP, lucyferazą, apyrazą) i substratami reakcji (adenozyno-5’ fosfosiarczanem (APS) i lucyferyną).
Standardowa metoda pirosekwencjonowania używa fragmentu Klenowa pol I pochodzącej z E.coli, czyli stosunkowo powolnego enzymu. Sulfurylaza ATP jest rekombinowaną wersją pochodzącą z drożdży Saccharomyces cerevisiae, lucyferaza pochodzi od świetlika Photinus pyralis, natomiast apyraza jest izolowana z ziemniaka.
Kolejnym etapem jest dodanie do mieszaniny reakcyjnej pierwszego rodzaju trifosforanu deoksyrybonukleotydu (DTP), który na zasadzie komplementarności może zostać przyłączony do jednoniciowej matrycy. Reakcja ta jest przeprowadzana przez polimerazę DNA i prowadzi do uwolnienia pirofosforanu (PPi) w ilości odpowiadającej liczbie przyłączonych nukleotydów.
Sulfurylaza ATP zamienia PPi na ATP, czyli adenozynotrójfosforan napędzający reakcję katalizowaną przez kolejny enzym – lucyferazę i polegającą na konwersji lucyferyny do oksolucyferyny. W procesie tym powstaje również światło widzialne, a siła jego sygnału jest uzależniona od ilości zużytego ATP. Szacuje się, że jeden pmol DNA w reakcji pirosekwencjonowania wytwarza 6 × 1011 cząsteczek ATP, które z kolei wytwarzają 6 × 109 fotonów o długości fali 560 nm.
Powstałe błyski są wykrywane przez fotodiodę, fotopowielacz lub też układ elementów światłoczułych zwany matrycą CCD (ang. Charge Coupled Device) i zostają utrwalone na wykresie zwanym pyrogramem. Wysokość i ilość pików jest w nim proporcjonalna do liczby przyłączonych nukleotydów, a ich kolejność pozwala bezpośrednio odczytać sekwencję powstającej nici.
dNTP, które nie zostały przyłączone do matrycy są degradowane przez apyrazę i dopiero kiedy proces ten zostanie zakończony, można dodawać do mieszaniny następne nukleotydy. W przeciwnym razie, błysk trwałby przez cały czas syntezy, co uniemożliwiłoby odczytanie sekwencji DNA.
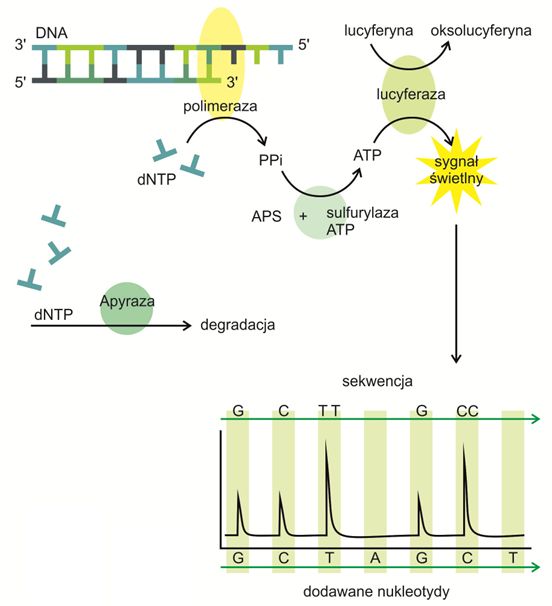
Rys 1. Przebieg pirosekwencjonowania
Modyfikacje metody
Po raz pierwszy, metoda sekwencjonowania poprzez syntezę została opisana w 1985 roku. Pomysł ten miał jednak wiele wad i wymagał wprowadzenia licznych udoskonaleń, m.in. zastosowania znakowanych nukleotydów.
Wciąż uzyskiwano jednak fałszywe sygnały po dodawaniu do mieszaniny dATP. Dopiero później udowodniono, że nukleotydy te są substratami lucyferazy i zaczęto stosować α-thio-dATP, wobec którego enzym pozostawał obojętny. Pozwoliło to wyeliminować zakłócenia w otrzymywanym sygnale.
Kolejnym ulepszeniem było dodanie do mieszaniny reakcyjnej apyrazy i utworzenie w ten sposób systemu złożonego z czterech enzymów. Było to początek tzw. pirosekwencjonowania fazy ciekłej (ang. liquid-phase pyrosequencing), które pozwoliło na zrezygnowanie z etapu wymywania zbędnych nukleotydów.
Wczesne wersje metody, zwane pirosekwencjonowaniem fazy stałej (ang. solid-phase pyrosequencing) wykorzystywały jedynie trzy enzymy – polimerazę DNA, sulfurylazę ATP, lucyferazę – oraz DNA unieruchomione na nośniku lub inaczej membranie.
Do mieszaniny reakcyjnej dodano także białko wiążące ssDNA. Pozwala ono na optymalizację parametrów procesu, daje pewną dowolność w projektowaniu primerów oraz jest pożyteczne podczas sekwencjonowania trudnych matryc tzn. ulegających zagięciu lub zapętleniu.
Zalety i wady techniki
Pirosekwencjonowanie jest techniką prostą w użyciu i nadającą się do ilościowych analiz sekwencji DNA, jednak w jednym eksperymencie można za jej pomocą odczytać zaledwie kilkadziesiąt par zasad.
W odróżnieniu od innych technik sekwencjonowania, metoda ta nie wymaga jednak zastosowania elektroforezy, ani innego sposobu rozdzielania fragmentów DNA, co w znaczny sposób zwiększa jej szybkość. Tempo uzyskiwania sekwencji jest 100 razy większe niż z w przypadku metody terminacji łańcucha. W temperaturze pokojowej cała reakcja od polimeryzacji do wykrycia światła trwa od 3-4 sekund.
Zastosowanie chemiluminescencji wpływa przy tym pozytywnie na czułość metody. Każdą reakcję można prowadzić w bardzo małej objętości, sięgającej nawet jednego pikolitra.
Kolejną niewątpliwą zaletą tej techniki jest również jej wysoka specyficzność uzyskiwana dzięki odpowiednio wyznakowanym starterom oraz wykorzystaniu jednoniciowej matrycy otrzymywanej w reakcji PCR. Dzięki temu uzyskuje się pewność, że badana próbka zawiera tylko i wyłącznie analizowany fragment DNA.
Ponadto, ze względu na cykliczność całego procesu, pirosekwencjonowanie można poddać praktycznie całkowitej automatyzacji. Trzeba jedynie odpowiednio przygotować badane próbki oraz uzupełnić dozowniki z reagentami. Jednoczesne analizowanie dużej liczby prób pozwala natomiast na obniżenie kosztów prowadzonych badań.
Zastosowanie techniki
Pirosekwencjonowanie jest jedną z metod ustalanie kolejności par nukleotydowych, które to badanie stanowi obecnie jedno z podstawowych narzędzi badania systemów biologicznych. Unikwatowe właściwości tej techniki czynią ją wyjątkowo korzystną do pewnych zastosowań. Metodę tą stosuje się głównie w sytuacjach, w których konieczne jest szybkie poznanie sekwencji wielu krótkich fragmentów, np. w mikrobiologii m.in. do identyfikacji poszczególnych gatunków bakterii (analizy 16S rDNA i rnpB) grzybów (region ITS2) i wirusów (grypy, Human Papilloma Virus, Herpes Simplex Virus) oraz do wykrywanie odporności na leki m.in. na Adamentan występującą u wirusa grypy, czy też Ciprofloksacynę u Neisseria gonorrhoeae), podczas analiz metylacji wysp CpG DNA, których zaburzenia mogą doprowadzić do przemiany nowotworowej komórki, a także w genetyce klinicznej (do wykrywania mutacji i polimorfizmów pojedynczych nukleotydów), hematologii, farmakogenetyce oraz wielu innych dziedzinach.
Autor: Anna Kurcek
Literatura:
1. Brown T.A., 2012. Genomy. Warszawa Wydawnictwo Naukowe PWN.
2. Ronaghi M., 2001. Pyrosequencing Sheds Light on DNA Sequencing. Genome Research 11; 3-11. http://genome.cshlp.org/
3. http://www.pyrosequencing.com/
4. Borkowska P., 2009. Pirosekwencjonowanie – sekwencjonowanie w czasie rzeczywistym. http://lab-all.com/

