Apoptoza to jeden z rodzajów śmierci komórkowej. Jej nazwa pochodzi z języka greckiego i oznacza opadanie płatków kwiatów, bądź liści. Pierwsza część wyrazu – „apo” nawiązuje do pozornego wyciekania komórek do przestrzeni międzykomórkowej, natomiast „ptosis” dotyczy usunięcia komórek z tkanki.
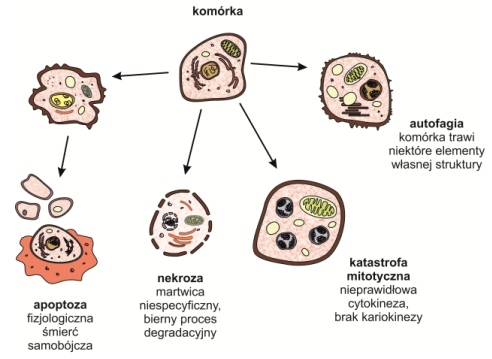
Rys. 1. Rodzaje śmierci komórkowej
Apoptoza jest niezbędna do zachowania homeostazy tkankowej. Jej biologiczna rola polega na eliminowaniu zużytych i uszkodzonych komórek, które mogłyby być szkodliwe dla organizmu. Do samobójczej śmierci zdolna jest większość komórek, jednak łatwość z jaką wchodzą one na drogę apoptozy zależy od ich typu i stopnia rozwoju. Proces ten zaobserwowano zarówno podczas embriogenezy (kształtowanie układu nerwowego ssaków, tworzenie komórek soczewki oka) jak i u organizmów dorosłych (np. segregacja dojrzewających limfocytów T w grasicy).
Zmiany zachodzące w komórce podczas apoptozy
Zmiany morfologiczne:
– zmiana symetrii błony komórkowej przy zachowaniu jej integralności;
– odwodnienie i zmiana kształtu komórki;
– kondensacja chromatyny oraz jej agregacja przy nukleoplazmie;
– tworzenie się pęcherzyków poprzez otoczanie błoną komórkową fragmentującej cytoplazmy (ang. blebbing);
– odpączkowywanie ciałek apoptotycznych (odrywanych od komórki macierzystej pęcherzyków).
Zmiany biochemiczne:
– translokacja fosfatydyloseryny PS do zewnętrznej warstwy błony komórkowej;
– aktywacja fosfataz i kinaz białkowych;
– wydzielenie cytochromu c i czynnika AIF (ang. apoptosis inducing factor) z mitochondriów;
– aktywacja kaskady kaspaz;
– cięcie DNA na mono- i oligonukleosomy (powstaje drabinka nukleosomowa) przez endonukleazę CAD (ang. caspase-activated deoxyribonuclease);
– zużycie energii zgromadzonej w ATP.
Odpowiedź tkankowa indukowana jest przez:
a) zmiany fizjologiczne (w dopływie hormonów do komórki, spadek poziomu czynników troficznych i wzrostowych);
b) działanie toksyn (zewnętrznych czynników uszkadzających i toksyn komórkowych: wolnych rodników, ekscytotoksyn, jonów wapnia);
– zachodzi w pojedynczych komórkach rozsianych w prawidłowej tkance;
– fagocytoza przez rezydujące komórki żerne oraz wędrujące makrofagi;
– nie wywołuje odpowiedzi zapalnej.
Aktywacja fizjologicznej śmierci komórki może zachodzić pod wpływem wielu różnych czynników:
• biologicznych, takich jak zakażenia (np. Helicobacter pylori, wirusami), niedobór czynników wzrostu, sygnały śmierci wysyłane przez inne komórki, produkty limfocytów Tc (np. cytokiny, perforyny);
• chemicznych, czyli stresu oksydacyjnego wywołanego obecnością reaktywnych form tlenu, chemoterapeutyków stosowanych w terapii przeciwnowotworowej;
• fizycznych, to jest promieniowania jonizującego, szoku termicznego.
Apoptoza to aktywny, zaprogramowanym przez komórkę proces. Związany jest on z aktywacją specyficznych genów, które pozwalają na zachowanie równowagi między procesami proliferacji i śmierci komórek. Ekspresję genów zaangażowanych w proces samobójczej śmierci reguluje m.in. czynnik transkrypcyjny NFкB.
Przykładem genów specyficznych dla śmierci fizjologicznej są proapoptotyczne geny ced-3 i ced-4. Biorą one udział w procesie morfogenezy u nicienia Caenorhabditis elegant. Ssaczym homologiem ced-3 jest gen kodujący należące do kaspaz białko ICE (ang. interleukin-1β-converting enzyme). Negatywnym regulatorem aktywności tych genów jest antyapoptotyczny gen ced-9 działający podobnie jak ssaczy gen bcl-2. Jego ekspresja jest cechą charakterystyczną dla tych tkanek, u których apoptoza ma za zadanie regulowanie ich rozwoju oraz przyczynia się do wymiany komórek na nowe.
Typowym przykładem genów aktywowanych nie tylko podczas procesu apoptozy są protoonkogeny będące czynnikami transkrypcyjnymi, np. c-myc, c-fos, c-jun. W odpowiedzi komórkowej uczestniczą również geny niektórych cyklin i kinaz cyklinozależnych oraz geny takie jak Rb oraz „strażnik genomu”, czyli gen p53. Wydłuża on fazę G1 cyklu komórkowego umożliwiając w ten sposób naprawę uszkodzonego DNA i dzięki czemu zapobiega przekazywaniu komórkom potomnym zaburzeń genetycznych. W przypadku zbyt dużych uszkodzeń DNA gen ten indukuje proces apoptozy.
Enzymy biorące udział w procesie apoptozy:
• Kaspazy (ang. cysteine-dependent aspartate specific protease) – proteinazy cysteinowe, enzymy trawiące białka jądrowe i cytoplazmatyczne. Ich charakterystyczną cechą jest to, że tną swoje substraty zawsze w miejscach zlokalizowanych obok reszty asparaginianowej. Kaspazy składają się z dwóch różniących się wielkością podjednostek. W mniejszej z nich zlokalizowane są reszty aminokwasowe tworzące centrum aktywne enzymu. W większej znajduje się reszta cysteinowa, której kaspazy zawdzięczają swoją nazwę. Proteinazy cysteinowe produkowane są przez komórkę w formie nieaktywnych zymogenów. Obie podjednostki rozdzielone są w nich domeną o charakterze regulatorowymi, a do N-końca dołączona jest dodatkowa prodomena. Ulegająca proteolitycznemu cięciu prokaspaza tworzy dwa fragmenty: duży (17-20 kDa) i mały (10-12 kDa), które następnie łączą się ze sobą w formę aktywną enzymu. Aktywacja kaspaz zachodzi w sposób schierarchizowany (tzw. „kaskada kaspaz”), na drodze proteolizy i oligomeryzacji. Jako pierwsze aktywowane zastają kaspazy inicjatorowe (-2, -8, -9, -10). Ich rola polega na aktywacji tzw. kaspaz efektorowych (-3, -6, -7), spośród których najważniejsza jest kaspaza 3, odpowiedzialna za hydrolizę białek cytoszkieletu (m. in. aktyny i spektryny) oraz błony otaczającej jądro komórkowe. Przeprowadza ona również aktywną proteolizę inhibitora DNazy DFF40/CAD (ang. DNA fragmentation factor 40kDa/caspase-activated deoxyribonuclease) – enzymu degradującego DNA.
• enzymy endonukleolityczne odpowiedzialne za degradację kwasów nukleinowych komórki: nukleazy NUC-18, DNaza I oraz DNaza II. Są one zależne od obecności jonów wapnia i magnezu oraz hamowane działaniem jonów cynku.
• transglutaminazy tworzące ciałka apoptotyczne, przeprowadzające polimeryzację białek cytoplazmatycznych oraz tworzące pomiędzy nimi wiązania krzyżowe.
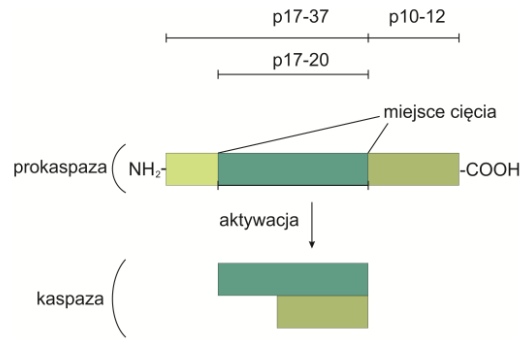
Rys. 2. Aktywacja kaspazy
Istnieją dwie podstawowe drogi prowadzące do apoptozy komórki. Wywoływane są one różnymi czynnikami oraz cechują się całkowicie odmiennym przebiegiem w fazie początkowej.
Szlak zależny od mitochondriów, czyli inaczej szlak wewnętrzny
Na skutek uszkodzenia DNA, pozbawienia komórek czynników wzrostu, niedotlenienia lub za pośrednictwem onkogenów, w błonie mitochondriów utworzone zostają kanały przez które uwalniane są czynniki apoptotyczne.
Zmiany przepuszczalności błon mitochondrialnych powodują spadek ich potencjału elektrochemicznego, zmianę wewnątrzkomórkowego pH oraz utratę zgromadzonego GSH, NAD(P)H i jonów wapnia. Powstawanie kanałów może również prowadzić do produkcji reaktywnych form tlenu (RFT) indukujących tzw. stres oksydacyjny.
Proces apoptozy regulują białka z rodziny Bcl-2. Ich funkcja nie jest jednorodna, gdyż należą do niech zarówno czynniki proaoptotyczne jak i antyapoptotyczne. Ich wzajemne oddziaływania decydują o śmierci lub przeżyciu komórki.
Tab. 2. Białka z rodziny Bcl-2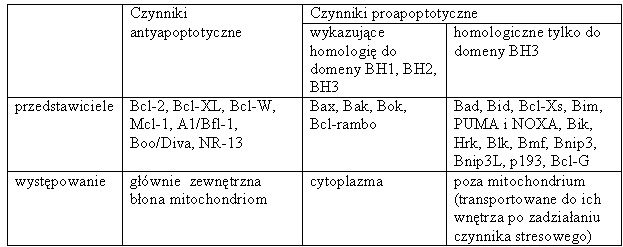
Spośród czynników apoptotycznych uwalnianych z przestrzeni międzybłonowej mitochondriów na szczególną uwagę zasługują cytochrom c oraz białko Apaf 1 (ang. apoptotic protease activating factor-1). Razem tworzą one kompleks zwany apoptosomem, uczynniajacy kaspazę 9, czyli bezpośredni aktywator kaspazy 3.
Innymi uwalnianymi czynnikami są endonukleaza G i AIF. Ostatni czynnik po uwolnieniu do cytoplazmy transportowany jest do jądra komórkowego, gdzie następnie aktywuje odpowiednie kaspazy przeprowadzające fragmentację chromatyny jądrowej.
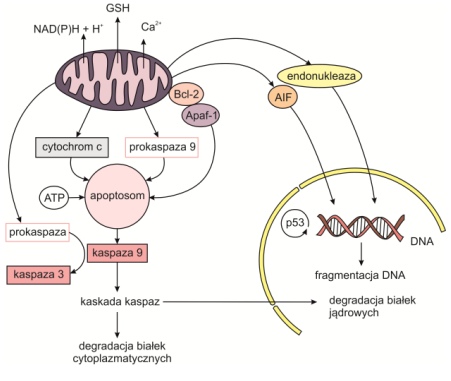
Rys. 3. Wewnętrzny szlak apoptotyczny
Szlak zależny od receptorów śmierci, czyli szlak zewnętrzny
Rozpoczyna się on od pobudzenia błonowych receptorów śmierci DR (ang. Death Receptor) należących do nadrodziny TNF, charakteryzującej się posiadaniem wewnątrzkomórkowej domeny śmierci DD (ang. Death Domain). Wiąże ona zarówno ligand, jak i cytoplazmatyczne białka adaptorowe (np. FADD (ang. Fas-Associated Death Domain)) tworząc kompleks DISC (ang. Death Inducing Signaling Complex), który uczynnia kaspazę 8 – bezpośredni aktywator kaspazy 3. W ten sposób uruchomiona zostaje kaskada kaspaz, prowadząca do apoptozy komórki. Kaspazy mogą być również aktywowane przez ceramidy. Są one przekaźnikami sygnału apoptotycznego, łączącymi szlak zewnętrzny ze szlakiem mitochondrialnym.
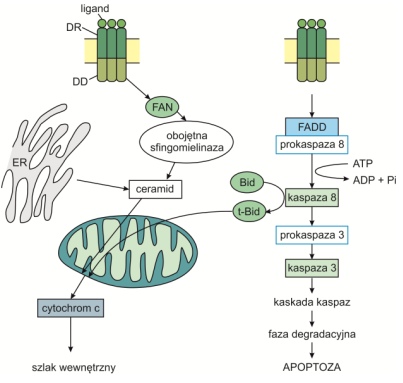
Rys. 4. Zewnętrzny szlak indukcji apoptozy
Anna Kurcek
Literatura:
• Iwona Grądzka. Mechanizmy i regulacja programowanej śmierci komórek. Postępy Biochemii 52, 157-165, 2006;
• Dorota Sulejczak. Apoptoza i metody jej identyfikacji. Postępy Biologii Komórki 27, 527-568, 2000;
• Zofia Walter, Joanna Mankiewicz. Apoptoza i metody jej badania. Acta Universitatis Lodziensis Folia Biochemica et Biophysica 14, 141-148, 1999;
• Beata Smolarz, Bogdan Westfal, Elżbieta Kozłowska, Hanna Romanowicz-Makowska, Marek Zadrożny, T. Pertyński, T. Stetkiewicz. Analiza apoptozy u chorych na raka piersi. Przegląd Menopauzalny 1, 28–33, 2004;
• Monika Baś, Anna Cywińska, Justyna Sokołowska, Małgorzata Krzyżowska. Apoptoza – programowana śmierć komórki. Część III. Rola apoptozy w procesach fizjologicznych i patologicznych. Życie Weterynaryjne 79, 671- 675, 2004;
• Ewa Missol-Kolka, Iwona Mitrus, Stanisław Szala. Geny proapoptotyczne w terapii genowej nowotworów. Współczesna Onkologia 6, 242-249, 2001;
• Robert Nowak, Jolanta Tarasiuk. Hamowanie procesu apoptozy w komórkach nowotworowych opornych na działanie leków przeciwnowotworowych. Postępy Biochemii 50, 331-343, 2004;
• Jolanta Bednarek. Białka przestrzeni międzybłonowej mitochondriów uczestniczące w procesie apoptozy. Postępy Biochemii 51, 447-458, 2005;

