PRZEDRUK, oryginał dostępny pod adresem www
Uniwersytet Gdański (www)
Wydział Chemii (www)
Katedry Chemii Bioorganicznej (www)
Kierownik: Prof. dr hab. Krzysztof Rolka
Adres:
ul. Sobieskiego 18/19
80-952 Gdańsk
Kontakt: tel. 58 52 35 386
____________________________________________________________________________
Karotenoidy to grupa około 100 barwników roślinnych, do których zaliczamy karoteny i ksantofile. Są one tetraterpenami, czyli podczas syntezy powstają z ośmiu jednostek aktywnego, pięciowęglowego izoprenu, a więc mają 40 atomów węgla. Zwierzęta nie potrafią produkować karotenoidów, ale mają zdolność do gromadzenia ich w wątrobie. Wytwarzane są one natomiast bardzo powszechnie przez bakterie, glony i rośliny wyższe. U roślin występują głównie w kwiatach, owocach, liściach i nasionach. Miejscem ich produkcji i kumulacji są wyspecjalizowane organella: chromoplasty i chloroplasty (liście). W chloroplastach karotenoidy towarzyszą chlorofilowi – zielonemu barwnikowi istotnemu w procesie fotosyntezy i są przez niego maskowane. Dopiero jesienią, gdy roślina odprowadza cenny chlorofil z liści, przed naszymi oczami ukazują się barwy karotenoidów w pełnej krasie. Karoten to barwnik o kolorze pomarańczowym. Na największą uwagę zasługuje tzw. β–karoten, który stanowi przeciętnie 80% wszystkich karotenów roślin wyższych. Widmo absorpcyjne karotenu pokazano poniżej.
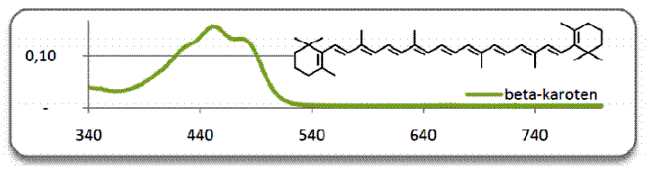
Rys. 1. Widmo absorpcyjne karotenu
Maksima absorpcji przypadają na 451 i 477 nm. Szczególnie obficie występuje on w korzeniu marchwi. Od marchwi pochodzi zresztą nazwa karotenu, bo Daucus carota to łacińska nazwa tej rośliny. Dla zwierząt wyższych zasadnicze znaczenie ma tylko β–karoten. To właśnie z niego produkują one witaminę A – retinol, którego dalsze produkty przemiany mają istotne znaczenie w procesie widzenia (wchodzą w skład barwnika wzrokowego – rodopsyny). Dlatego β–karoten nazywany jest prowitaminą A. Zawarty w diecie karoten pełni funkcje ochronne przed chorobą wieńcową u osób palących papierosy lub ulegających ekspozycji na dym papierosowy. W grupie osób przyjmujących preparaty β–karotenu przez 5 lat stwierdzono o 54% rzadsze występowanie nowych przypadków chorób sercowo-naczyniowych, w tym choroby wieńcowej.
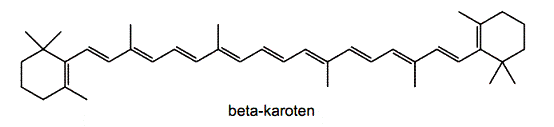
Wzór 1. Beta-karoten
Ksantofile to pochodne tlenowe karotenów (hydroksylowe, ketonowe, aldehydowe, karboksylowe). Mają barwę żółtą lub brązową (gr. ksanthos – żółty). Powstają one przy utlenianiu karotenów przy pomocy enzymów – tzw. oksydaz mieszanych. Najbardziej popularne są pochodne hydroksylowe, których najbardziej rozpowszechnionym przedstawicielem jest luteina.
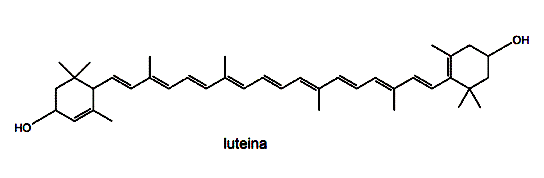
Wzór 2. Luteina
Wśród jesiennych liści spotykamy też barwę intensywnie czerwoną. Odpowiedzialne za nią są jednak inne barwniki – antocyjany, które w przeciwieństwie do karotenoidów, nie występują w liściach cały czas, ale są jesienią specjalnie syntetyzowane.
Odczynniki i sprzęt:
1. Materiał roślinny (brzoskwinia, marchew, dynia, przecier pomidorowy)
2. Żel krzemionkowy Silica Gel 60 (Merck)
3. Mieszanina ekstrakcyjna: aceton : eter naftowy (22 : 3; v/v)
4. Eluent: eter naftowy : aceton (7 : 3; v/v)
5. 10% wodny roztwór NaCl
6. Bezwodny Na2SO4 (lub MgSO4)
7. Szkło laboratoryjne: moździerz, rozdzielacz o pojemności 100 mL, lejek zwykły, kolby stożkowe i okrągłodenne, zlewki, probówki, pipety miarowe, cylindry miarowe
8. Zestaw do chromatografii kolumnowej
9. Bibuła filtracyjna
10. Wyparka rotacyjna próżniowa
Wykonanie doświadczenia:
Ekstrakcja barwników z materiału roślinnego
Poddać homogenizacji 3 g materiału roślinnego (marchew, dynia, brzoskwinia) w 10 mL mieszaniny aceton : eter naftowy (22 : 3; v/v). Mieszaninę przesączyć do rozdzielacza przez sączek z bibuły. Do ekstraktu dodać 15 mL eteru naftowego i 15 mL 10% roztworu NaCl. Wytrząsać 2-3 minuty. Po rozdzieleniu się warstw, usunąć dolną warstwę wodną, a górną warstwę organiczną przemyć wodą destylowaną (3×5 mL). Przemyty ekstrakt wysuszyć w kolbie płaskodennej za pomocą bezwodnego Na2SO4 (lub MgSO4). Po wysuszeniu, roztwór przesączyć do kolbki okrągłodennej i zagęścić do 20-30% początkowej objętości.
Przygotowanie kolumny chromatograficznej
Kolumnę chromatograficzną umieścić pionowo w statywie, zamknąć jej wylot zaciskaczem i wypełnić ją około 10 mL mieszaniny eter naftowy : aceton (7 : 3; v/v). Następnie przy pomocy bagietki umieścić na dnie kolumny tamponik z waty szklanej uważając, aby nie powstały pęcherzyki powietrza. Ostrożnie wlać (po bagietce) do kolumny zamieszaną uprzednio zawiesinę żelu krzemionkowego Silica Gel 60 (Merck) w układzie eluującym. Zawiesina w zlewce powinna być przygotowana tak, aby 2/3 jej objętości stanowił żel, a 1/3 mieszanina eter naftowy : aceton (7 : 3; v/v). Należy pracować możliwie szybko, aby nie dopuścić do odparowania rozpuszczalników. Następnie odczekać, aż na dnie kolumny uformuje się warstwa żelu 3-5 cm, po czym ostrożnie otworzyć zacisk kolumny. Roztwór powinien wypływać z szybkością 1 kropli/sekundę. Wysokość uformowanego żelu powinna wynosić 25 cm. Następnie na szczycie kolumny umieścić krążek z bibuły filtracyjnej i zamknąć wylot kolumny, pozostawiwszy nad powierzchnią minimum 2 cm roztworu, bacznie uważając, aby nie doszło do zapowietrzenia kolumny.
Równoważenie kolumny chromatograficznej
Kolumnę z uformowanym żelem krzemionkowym połączyć ze zbiornikiem zawierającym 500 mL mieszaniny eter naftowy : aceton (7 : 3; v/v), otworzyć zacisk u dołu kolumny i przepuścić przez nią około 60 mL roztworu. Szybkość przepływu powinna wynosić około 1 mL/min. Szybkość tę reguluje się poprzez zmianę położenia zbiornika w stosunku do kolumny.
Rozdział ekstraktu
2 mL zatężonego ekstraktu roślinnego nanieść na czoło kolumny. Po wsiąknięciu w żel ostrożnie dodać 4-5 mL eluentu i podłączyć rezerwuar z eluentem. Otworzyć wylot na dole kolumny i rozpocząć elucję barwników. Eluat zbierać do probówek, do każdej po 3 mL. Zaobserwować pojawianie się różnokolorowych stref w trakcie rozdziału. Eluent zawierający chlorofil i feofitynę wykazuje czerwonawą fluorescencję. Na podstawie barwy, fluorescencji i widma UV (maksimum absorpcji dla karotenu znajduje się przy długościach fal 451 i 477 nm) zanotować kolejność elucji poszczególnych barwników.

