PRZEDRUK, oryginał dostępny pod adresem www
Politechnika Śląska (www)
Wydział Chemiczny (www)
Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii (www)
Kierownik Katedry: dr hab. inż. Mirosław Gibas prof. Politechniki Śląskiej
Adres:
ul. B. Krzywoustego 4
44-100 Gliwice
Zadanie 1. Wykrywanie oksydaz w ziemniaku
Sprzęt:
– statyw z probówkami,
– pipety
Materiał i odczynniki:
– wyciąg ziemniaczany,
– 1% roztwór fenolu,
– 1% roztwór pirokatechiny,
– 1% roztwór pirogalolu,
– 1% roztwór NaCN.
Wykonanie ćwiczenia:
Sporządzenie wyciągu ziemniaczanego:
Umyty i obrany ziemniak należy utrzeć na tarce. Miazgę włożyć do płóciennego woreczka i zanurzyć w zlewce z około 200 ml wody. Zawartość zlewki łagodnie wymieszać. W ten sposób uzyskuje się ekstrakt wodny zawierający enzymy i skrobię.
Jak skrobia opadnie na dno zlewki, należy zdekantować ciecz nadosadową i używać do doświadczeń.
Przygotować trzy probówki, wlać do nich po 5 ml wyciągu ziemniaczanego. Do pierwszej probówki dodać 10 kropli 1% fenolu, do drugiej 10 kropli 1% pirokatechiny, do trzeciej 10 kropli 1% pirogalolu. Zawartość probówek wymieszać i obserwować zmiany zabarwienia. Zanotować nasilenie barwy w probówkach zawierających poszczególne fenole oraz czas po jakim pojawia się zabarwienie.
Wykonać analogiczne ćwiczenie po dodaniu kropli 1% roztworu NaCN.
Zadanie 2. Wykrywanie peroksydaz w ziemniaku
Sprzęt:
– statyw z probówkami,
– pipety
Materiał i odczynniki
– wyciąg ziemniaczany,
– 1% roztwór fenolu,
– 1% roztwór pirokatechiny,
– 1% roztwór pirogalolu,
– 3% roztwór H2O2,
– 4% roztwór benzydyny
Wykonanie ćwiczenia:
2a. Próba z fenolami:
Przygotować trzy probówki, wlać do nich po 5 ml wyciągu ziemniaczanego przygotowanego w zadaniu 1. Do pierwszej probówki dodać 10 kropli 1% fenolu, do drugiej 10 kropli 1% pirokatechiny, do trzeciej 10 kropli 1% pirogalolu, a następnie do każdej probówki wprowadzić dodatkowo po 10 kropli 3% roztworu H2O2. Zawartość probówek wymieszać i obserwować zmiany zabarwienia. Zanotować nasilenie barwy w probówkach zawierających poszczególne fenole oraz czas po jakim pojawia się zabarwienie.
2b. Próba benzydynowa:
Do 5 ml wyciągu ziemniaczanego przygotowanego w zadaniu 1 dodać kroplę 4% roztworu benzydyny i kilka kropli H2O2. Zanotować spostrzeżenia.
Zadanie 3. Wykrywanie peroksydaz w chrzanie
Sprzęt:
– statyw z probówkami,
– pipety
Materiał i odczynniki
– wyciąg wodny z korzenia chrzanu,
– chrzan tarty (kupny),
– 4% roztwór benzydyny
– 3% roztwór H2O2,
– 1% roztwór pirokatechiny,
– 1% roztwór pirogalolu,
– etanol
Wykonanie ćwiczenia:
Sporządzenie ekstraktu wodnego z korzenia chrzanu:
Kawałki korzenia ekstrahować kilkakrotnie etanolem i wysuszyć w temp. 37OC. Przez ekstrakcję wodą suchej pozostałości uzyskuje się roztwór peroksydazy, nie zawierający oksydaz. Po ekstrakcji etanolem korzeń chrzanu utrzeć na tarce i dodać około 100 ml wody, wymieszać i pozostawić do odstania, a następnie zdekantować roztwór znad osadu.
3a. Próba benzydynowa:
Do 3 ml wyciągu wodnego chrzanu dodać kroplę 4% roztworu benzydyny i kilka kropli 3% H2O2. Analogicznie wykonać próbę dla kupnego chrzanu tartego. Zanotować spostrzeżenia i wnioski.
3b. Próba z fenolami:
Do dwóch probówek wprowadzić po 3 ml wyciągu wodnego z korzenia chrzanu. Do jednej dodać 10 kropli 1% pirokatechiny, do drugiej 10 kropli 1% pirogalolu, a nastepnie dodac do obu po 10 kropli 3% H2O2. Zanotować spostrzeżenia.
Zadanie 4. Porównanie wrażliwości oksydaz i peroksydaz na temperaturę
Sprzęt:
– statyw z probówkami,
– pipety,
– łaźnia wodna 70OC
Materiał i odczynniki:
– wyciąg ziemniaczany,
– 1% roztwór pirokatechiny,
– 3% roztwór H2O2.
Wykonanie ćwiczenia:
Do dwóch probówek odmierzyć po 5 ml wyciągu ziemniaczanego przygotowanego w zadaniu 1. Ogrzewać probówki na łaźni wodnej w temperaturze 70OC przez 10 minut. Do jednej dodać 10 kropli 1% roztworu pirokatechiny, a do drugiej 10 kropli 1% roztworu pirokatechiny i 10 kropli 3% roztworu H2O2. Zanotować wyniki.
Zadanie 5. Wykrywanie katalazy w ziemniakach i chrzanie
Sprzęt:
– statyw z probówkami,
– pipety,
– łaźnia lodowa.
Materiał i odczynniki:
– wyciąg wodny z korzenia chrzanu,
– wyciąg ziemniaczany,
– 3% roztwór H2O2,
– 1% roztwór NaCN,
Wykonanie ćwiczenia:
5a. Do probówki wprowadzić 2 ml wyciągu ziemniaczanego, do drugiej 2 ml wyciągu z chrzanu i dodać kilka kropli 3% H2O2. Pod działaniem katalazy następuje obfite wydzielanie tlenu.
5b. Powtórzyć ćwiczenie po:
– uprzednim ogrzaniu wyciągów enzymatycznych do wrzenia,
– uprzednim wstawieniu probówek do łaźni lodowej na 15 minut,
– dodaniu do wyciągów 1 kropli roztworu NaCN.
Zadanie 6. Wykrywanie oksydazy ksantynowej w mleku
Sprzęt:
– statyw z probówkami,
– pipety,
– łaźnia wodna 40OC,
– zlewka o poj. 250 ml.
Materiał i odczynniki:
– mleko świeże,
– mleko przegotowane,
– 0,5% roztwór aldehydu mrówkowego
– 0,02% roztwór błękitu metylenowego,
– ciekła parafina
Wykonanie ćwiczenia:
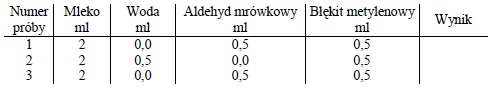
Do trzech numerowanych probówek odmierzyć podane w tabelce ilości mleka (enzym), aldehydu mrówkowego (substrat) oraz błękitu metylenowego (akceptor wodoru). Do probówki 3 (kontrolna) zamiast mleka świeżego należy dodać mleko przegotowane. Do wszystkich probówek dodać 1 ml płynnej parafiny celem zabezpieczenia prób przed tlenem powietrza. Probówki wstawić do łaźni wodnej o temperaturze 40OC. Zanotować czas potrzebny do odbarwienia lub osłabienia barwy w próbach.