PRZEDRUK, oryginał dostępny pod adresem www
Fragment skryptu: Spektroskopia Masowa
Autor skryptu: dr Barbara Drożdż
Uniwersytet Jagielloński (www)
Wydział Farmaceutyczny Collegium Medicum (www)
Katedra Chemii Organicznej (www)
Kierownik: Prof. UJ, dr hab. Marek Cegła
Adres:
ul. Medyczna 9
30-688 Kraków
Kontakt: tel. 012 620 55 00
<img src=”http://e-biotechnologia.pl/obrazki/spektroskopia_masowa.jpg” ALIGN=”left” alt=”spektroskopia masowa” HSPACE=10 VSPACE=10/>Masa jest wielkością fizyczną określającą ilość materii. W układzie SI jednostką masy jest kilogram. W chemii służy głównie do obliczeń stechiometrycznych prowadzonych reakcji. Najczęstszym źródłem, z którego korzysta chemik do określenia masy pierwiastków jest układ okresowy lub tablice fizykochemiczne, jednak zawarte tam wartości mas nie nadają się do obliczeń mas cząsteczek docierających do detektora spektrometru masowego.
Przed przystąpieniem do interpretacji widm masowych należy przypomnieć sobie wszystkie sposoby określania masy stosowane w chemii, aby móc odpowiedzieć, którą z nich możemy odczytać z widma masowego.
Bezwzględna masa atomowa i cząsteczkowa
Masa atomów i cząsteczek wyrażona w kilogramach. Przykładowo dla atomu wodoru wynosi 1.66057×10-27 kg. W spektrometrii masowej masa bezwzględna jest wykorzystywana do obliczeń promienia krzywizny toru ruchu cząstek naładowanych w analizatorze jonów.
Masa atomowa i cząsteczkowa
Masa atomowa (względna masa atomowa) wskazuje ile razy masa danego atomu jest większa od 1/12 masy nuklidu atomu węgla 12C. Oznaczeniem jednostki masy atomowej jest symbol u (unit) lub dalton [Da].
1 u = 1 Da = 1/12 masy atomu 12C o masie bezwzględnej = 1,66057×10-27 kg.
Masa atomowa jest masą atomu wyrażoną w jednostkach masy atomowej [u, Da ]. Ponieważ przyjęta masa nuklidu węgla 12C jest równa 12.0000 u, inne pierwiastki mają w tej skali masy ułamkowe np. masa atomu wodoru 1H wynosi 1.0078 u, a tlenu 16O 15.9949 u.
Masa cząsteczkowa jest sumą mas atomowych atomów wchodzących w skład cząsteczki. Przykładowo masa cząsteczkowa wodoru wynosi 2.0156 u.
Masa molowa pierwiastków i cząsteczek
Masa molowa jest liczbowo równa masie atomowej (lub cząsteczkowej), ale wyrażona jest w g/mol lub zgodnie z układem SI w kg/mol.
Masa izotopowa
Izotopami są atomy tego samego pierwiastka różniące się liczbą neutronów w jądrze, a tym samym liczbą masową. Masa izotopowa jest obliczana na podstawie dokładnych mas atomowych wybranych izotopów pierwiastków wchodzących w skład cząsteczki i wyrażona w jednostkach masy atomowej.
Przykładowo dla chlorometanu możemy obliczyć między innymi następujące masy izotopowe:
12C1H335Cl = (12.000 + 3 x 1.0078 + 34.9688)u = 49.9922u
12C1H337Cl = (12.000 + 3 x 1.0078 + 36.9659)u = 51.9893u
12C1H22H 35Cl = (12.000 + 2 x 1.0078 + 2.014 + 34.9688)u = 50.9984u
Średnia ważona masa atomowa i cząsteczkowa
(Średnia masa atomowa, cząsteczkowa)
Średnia masa atomowa (podawana np. w układzie okresowym) jest to masa obliczona jako średnia ważona izotopów pierwiastka uwzględniająca występujący w przyrodzie skład izotopowy; podawana jest w jednostkach masy atomowej [u].
Tabela 1. Masy izotopowe najczęściej spotykanych pierwiastków w chemii organicznej.
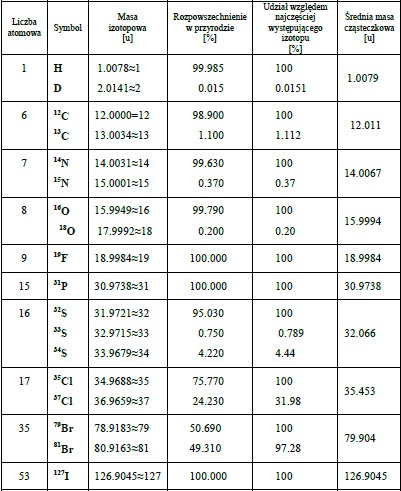

Przykładowo masa cząsteczkowa CCl4 (masy izotopów i ich udziały procentowe podaje tabela 1)
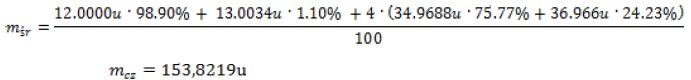
Masa w spektroskopii masowej
Wspomniana wysoka rozdzielczość, z jaką detektor w spektrometrze masowym rozróżnia masy docierających do niego jonów, wymaga posługiwania się w obliczeniach masami izotopowymi. Większość pierwiastków występuje w przyrodzie jako mieszanina izotopów, przy czym skład izotopowy jest stały i niezależny od pochodzenia próbki. W tabeli 1 przedstawiono składy izotopowe pierwiastków najczęściej spotykanych w chemii organicznej.
Szukając na widmie MS przykładowo piku jonu CH2Cl2+ musimy uwzględnić obecność nie tylko jonu 12C1H235Cl2+ , ale również jonów o innych składach: 12C1H235Cl37Cl+, 13C1H235Cl2+, 12C1H2H35Cl2+, 13C1H235Cl37Cl+ itd. Na szczęście wiele izotopów występuje bardzo rzadko, np. wodór, w związku z czym ich izotopy nie odgrywają istotnej roli w interpretacji widm MS.
Widmo masowe
Rodzaje jonów na widmie MS
Jon molekularny
Związki organiczne poddane działaniu strumienia elektronów o odpowiedniej energii ulegają rozpadom, z których najprostszy polega na utracie przez cząsteczkę jednego elektronu i utworzeniu jonu molekularnego (cząsteczkowego, masowego, macierzystego), oznaczanego M+ i pojawiającego się na widmie MS przy największych wartościach m/z (nie licząc pików jonów izotopowych, opisanych w dalszej części tekstu).
W omawianych tu spektrometrach z jonizacją EI wartość m/z odpowiadająca jonowi molekularnemu, ze względu na bardzo małą masę elektronu, jest równa masie cząsteczkowej badanego związku. Masa jonu M+ odpowiada zawsze masie cząsteczki złożonej z najlżejszych izotopów.
Piki molekularne nie są widoczne dla wszystkich związków. Nie posiadają ich prawie wszystkie długołańcuchowe związki nasycone, zarówno alkany jak i związki z grupami funkcyjnymi, np. alkohole czy aminy.
Jony fragmentacyjne
Jon molekularny może ulegać dalszym rozpadom dając obojętne cząsteczki, rodniki oraz dodatnio naładowane jony fragmentacyjne. Jony fragmentacyjne powstają zarówno przez rozpad wiązań, jak i poprzez różnego rodzaju przegrupowania, związane z tworzeniem nowych wiązań lub przeniesieniem atomu wodoru w obrębie cząsteczki.
Ten sam związek może ulegać fragmentacjom na różnych niezależnych od siebie drogach jak pokazano na poniższym schemacie:
Schemat obrazujący trzy różne drogi fragmentacji związku
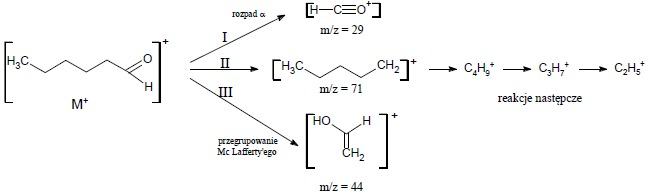
Intensywność piku jonu fragmentacyjnego zależy od szybkości tworzenia tego jonu i szybkości jego dalszego rozpadu w reakcjach następczych (fragmentacja wieloetapowa). W związkach organicznych rozpadowi ulegają przede wszystkim wiązania słabe o niskiej energii, natomiast wiązania wielokrotne (C=C, C=O) rzadko ulegają bezpośredniemu rozpadowi.
Intensywność pików pochodzących od jonów fragmentacyjnych opiera się między innymi na:
– trwałości karbokationów związanej ze wzrostem ich rzędowości ( CH3+ < RCH2+ < R2CH+ < R3C+ )
– trwałości kationów aromatycznych (kationu cyklopropenylowego i tropyliowego)
– możliwości wydzielenia w procesie fragmentacji stabilnych cząsteczek obojętnych, takich jak C2H2, CO, CO2, H2O, HCN, HCl.
Piki izotopowe
W spektrometrze masowym detektor rozróżnia jony różniące się masą o jedną jednostkę masy atomowej (lub w dokładniejszych spektrometrach o jej ułamkową część). Dlatego każdy jon molekularny lub fragmentacyjny może pojawić się jako układ kilku pików pochodzących od jonów o tym samym składzie pierwiastkowym, ale zbudowanych z różnych izotopów. Wzajemna wysokość tych pików jest zależna od procentowej zawartości określonego izotopu w przyrodzie (tabela 1). Ponieważ najlżejsze izotopy pierwiastków występują najczęściej, najwyższy pik odpowiada jonowi zbudowanemu z najlżejszych izotopów. Obok niego w kierunku wyższych wartości m/z pojawiają się piki izotopowe.
Analizując tabelę 1 można zauważyć, że największe znaczenie w interpretacji widm MS mają (ze względu na udział procentowy) jony izotopowe zawierające atomy chloru i bromu.
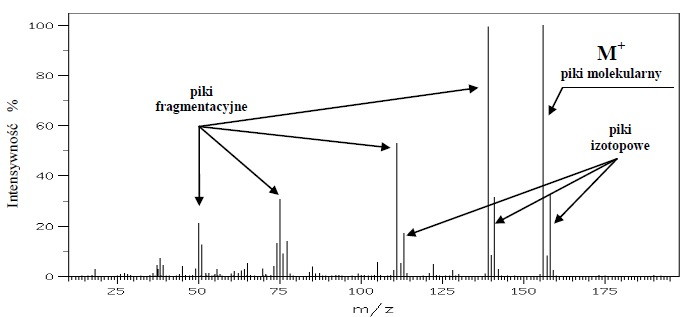
Rys.3 Widmo masowe kwasu p-chlorobenzoesowego z zaznaczonymi rodzajami pików.
Określenie ilości atomów węgla
Widmo masowe pozwala na określenie ilości atomów węgla w cząsteczce lub w jej fragmencie na podstawie porównania intensywności danego piku z jego pikiem izotopowym. Jednak rzeczywiście dokładne wyniki otrzymuje się w tej metodzie dla widm o dużej rozdzielczości. Jeżeli badany związek nie zawiera atomów azotu, liczbę atomów węgla określa się na podstawie intensywności piku [M+1]+. Intensywność piku [M+1]+ w stosunku do intensywności piku M+ powinna być procentowo równa liczbie atomów węgla w związku pomnożonej przez 1.1 (czyli procentowy udział węgla 13C – tabela 1). Przykładowo związek zawierający 10 atomów węgla będzie miał pik [M+1]+ o intensywności stanowiącej 11% intensywności piku M+ (1.1% x 10 atomów = 11%).
I odwrotnie, wiedząc, że intensywność piku [M+1]+ wynosi np. 13% względem piku M+, możemy wnioskować, że związek zawiera 12 atomów węgla ( 13% / 1.1% = 12 atomów).
Wskazania na obecność azotu
Związki organiczne zawierające nieparzystą liczbę atomów azotu mają zawsze nieparzyste masy cząsteczkowe (dotyczy to związku złożonego z głównych izotopów występujących w nim pierwiastków)– stwierdzenie to nosi nazwę reguły azotu.
Wskazania na obecność atomów chloru
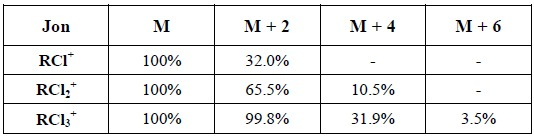
W widmie związku zawierającego jeden atom chloru pik izotopowy jonu molekularnego (M+ + 2) wykazuje intensywność 32 % względem intensywności piku jonu M+, co wynika z występowania w przyrodzie izotopów chloru 35Cl i 37Cl w takim właśnie stosunku (tabela 1). Identyczna zależność dotyczy również jonów fragmentacyjnych zawierających atom chloru. Jeżeli zakładamy obecność atomu chloru w analizowanym piku danego fragmentu np. pik o m/z = 145, to musi występować obok niego pik jonu o m/z = 147 i intensywności równej około jednej trzeciej wysokości piku o m/z = 145. Należy pamiętać, że detektor spektrometru masowego reaguje na obecność pojedynczych cząsteczek na niego padających, czyli przykładowo cząsteczki 12C1H335Cl o m/z = 50 lub cząsteczki 12C1H337Cl = 52. W związku z tym używanie masy atomu chloru równej 35.5 (używanej w obliczeniach stechiometrycznych) jest błędem.
Większa ilość atomów chloru w cząsteczce jonu powoduje powstanie dodatkowo pików izotopowych (M+ + 4), (M+ + 6) itd.
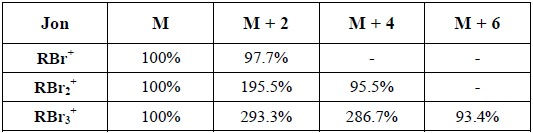
Tabela 2 Intensywności pików izotopowych jonów molekularnych zawierających chlor
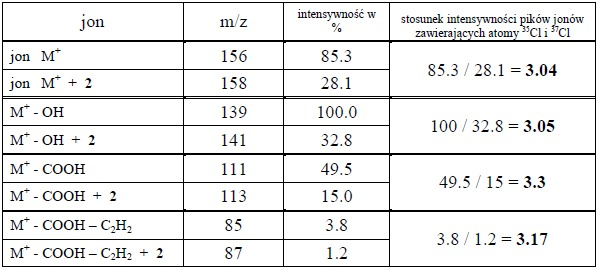
Poniżej (rys.4) pokazano przykładowe widmo oraz przebieg fragmentacji związku zawierającego jeden atom chloru (kwas p-chlorobenzoesowy). Z analizy tego widma (tabela 3) widać, że każdemu pikowi jonu zawierającego atom chloru towarzyszy pik izotopowy o odpowiedniej wysokości.
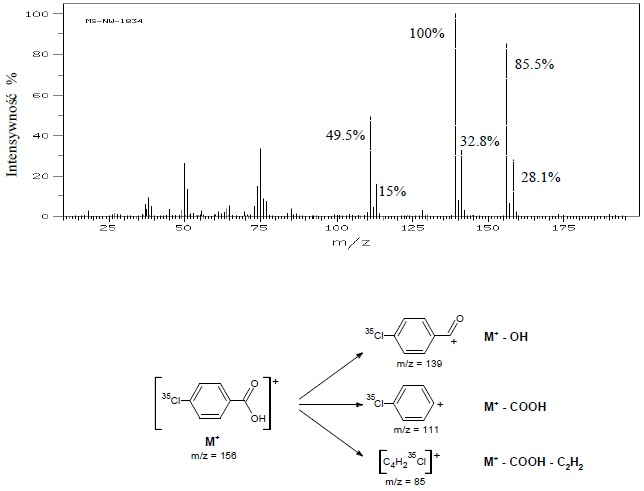
Rys.4 Widmo MS i drogi fragmentacji kwasu p-chlorobenzoesowego.
Tabela 3. Analiza wartości m/z i intensywności wybranych pików jonów powstających w spektrometrze MS dla kwasu p-chlorobenzoesowego.
Wskazania obecności atomów bromu Podobnie jak dla chloru wskaźnikiem obecności w cząsteczce atomu bromu jest pik (M+ + 2). Brom istnieje w przyrodzie w postaci dwóch izotopów 79Br i 81Br występujących w prawie równych ilościach. Ponieważ pojedyncza cząsteczka docierająca do detektora może zawierać tylko jeden z izotopów, nie wolno do obliczeń mas w MS przyjmować średniej masy izotopowej wynoszącej 80.
Tabela 4. Intensywności pików izotopowych jonów molekularnych zawierających brom.
Poniżej pokazano przykładowe widma związków zawierających jeden i dwa atomy bromu (rys.5 i 6).
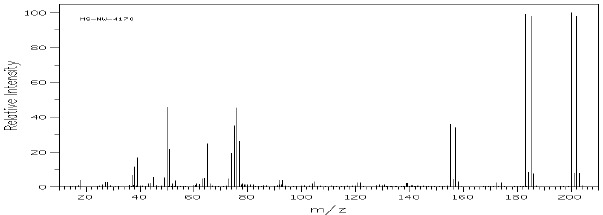
Rys.5 Widmo MS kwasu o-bromobenzoesowego.
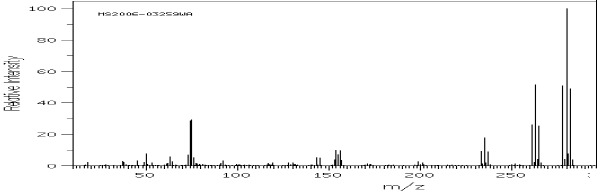
Rys.6 Widmo MS kwasu 2,5-dibromobenzoesowego.

