PRZEDRUK, oryginał dostępny pod adresem www
Opracował: mgr inż. Tadeusz Gorewoda
Politechnika Śląska (www)
Wydział Chemiczny (www)
Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii (www)
Kierownik Katedry: dr hab. inż. Mirosław Gibas prof. Politechniki Śląskiej
Adres:
ul. B. Krzywoustego 4
44-100 Gliwice
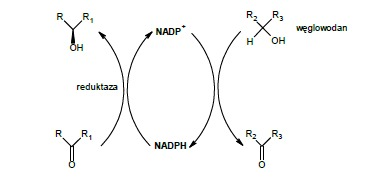
Już od prawie wieku drożdże piekarnicze (Saccharomyces cerevisiae) są obecne w syntezie organicznej. Przez ten czas stały się one jednymi z najbardziej popularnych biokatalizatorów komórkowych, stosowanych w różnych typach reakcji. Jednym z szerszych zastosowań tych organizmów są reakcje redukcji. pośród tych reakcji można wymienić: redukcje beta-ketoestrów, diketonów i ketokwasów; redukcje alfa-hydroksyaldehydów i alfa-hydroksyketonów do alfa,beta-dioli; redukcję związków zawierających wiązanie C=C; redukcję aromatycznych i nienasyconych ketonów; redukcję związków nitrowych.1 Wyżej wymienione reakcje mogą zachodzić dzięki obecności w komórkach drożdży enzymów z grupy reduktaz.
Podczas ćwiczenia zostaną przeprowadzone reakcje:
a) Redukcji beta-ketoestru do beta-hydroksyestru;
b) Redukcji wiązania podwójnego węgiel – węgiel;
1.1 Redukcja beta-ketoestru do beta-hydroksyestru
Spośród reakcji redukcji przebiegających z udziałem drożdży piekarskich najszerzej opisywaną grupą są redukcje beta-ketoestrów do beta-hydroksyestrów. Badania genomu S. cerevisiae wykazały 49 sekwencji kodujących białka zdolne do aktywności redukcyjnej. Wykazano różnice pomiędzy działaniem poszczególnych enzymów, ich aktywnością stereoselektywnością. Używając do reakcji wydzielone enzymy uzyskiwano doskonałe selektywności (>90% ee, >90% de). Użycie całych komórek drożdżowych dało w niektórych przypadkach nieco gorsze rezultaty.2 Wiąże się to z faktem działania całej gamy enzymów.
Dodatkowo taka metoda charakteryzuje się większą objętością mieszaniny reakcyjnej i większym balastem, niż użycie pojedyńczych enzymów. Jednakże za użyciem całych komórek drożdżowych przemawia istotny fakt, iż opisywane reakcje zachodzą z udziałem koezymu jakim jest NADPH (zredukowany fosforan dinukleotydu nikotynoamidoadeninowego). Aby koenzym ten mógł się regenerować, wymagane jest dostarczenie drożdżom węglowodanów (np. glukozy).
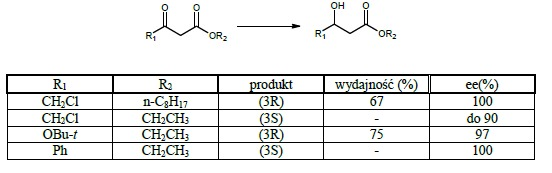
Największą zaletą redukcji ketoestrów z użyciem drożdży jest selektywność reakcji. W przypadku -niepodstawionych ketoestrów stwierdzono, iż wielkość podstawnika przy węglu C3 oraz podstawnika przy grupie estrowej wywiera istotny wpływ na enancjoselektywność reakcji. Wybierając odpowiednie podstawniki można więc uzyskać produkt o pożądanej konfiguracji z wysokim nadmiarem enancjomerycznym. Poniżej przedstawiono kilka przykładów:
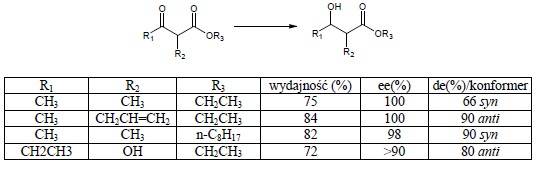
Redukcja alfa-podstawionych ketoestrów wiąże się dodatkowo z diastereoselektywnością (powstają dwa centra chiralne). Także w tym wypadku udało się uzyskać wysokie nadmiary enancjomeryczne i diastereomeryczne dzięki użyciu różnych podstawników w pozycjach 2, 3 oraz przy grupie estrowej.
Redukcja ketonów do alkoholi w klasycznej preparatyce organicznej może odbywać się na kilka sposobów. Główne z nich to:
a) Reakcje z wodorkami metali. Najczęściej używanymi związkami są LiAlH4 (glinowodorek litu) oraz NaBH4 (borowodorek sodu). Reakcja z użyciem LiAlH4 jest dość ogólna – poza grupą karbonylową redukowane są także inne grupy obecne w substracie np. NO2, CN, COOR itd. Borowodorek sodu jest bardziej selektywny i nie redukuje grup takich jak NO2 czy halogenowych. Dodatkową jego zaletą jest możliwość stosowania go w roztworach wodnych. Wodorki metali nie uwadarniają podwójnych ani potrójnych wiązań węgiel – węgiel (za wyjątkiem wiązań C=C sprzężonych z grupą COOR).
b) Redukcja z zastosowaniem wodoru gazowego i katalizatora (platyna, ruten, pallad, nikiel itp.). To rozwiązanie obciążone jest najmniejszą selektywnością – w tych warunkach zredukowane zostają także wiązania wielokrotne.
c) Reakcja z etanolanem sodu w alkoholu etylowym. Stosowana zanim odkryto LiAlH4, częściej stosowana do redukcji estrów niż ketonów.
d) Reakcja z diborowodorem B2H6.
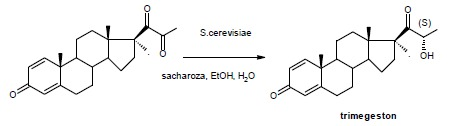
Opisane układy przez lata zyskały wiele modyfikacji. Ich najczęstszym celem było uzyskanie chemoslektywności reakcji. Uzyskuje się ją dzieki stosowaniu różnych warunków reakcji: kombinacji metal- jon wodorkowy, różnym katalizatorom i rozpuszczalnikom3. Jednakże stosowane wodorki metali, jak i katalizatory metaliczne są drogim i nie raz niewygodnym w pracy surowcem. Także praca z wodorem niesie za sobą nibezpieczeństwo. Z tego względu drożdże piekarnicze w ostatnich latach nabierają znaczenia na tym polu syntezy. Ich atrybutami są niska cena, niskie temperatury reakcji (30-40oC), zastosowanie wody jako rozpuszczalnika, aspekt ekologiczny. Daje to podstawy do zastosowania S. cerevisiae na poziomie przemysłowym. Jednym z zastosowań drożdży jest chemo, regio i wysoce stereospecyficzna redukcja triketonu do trimegestonu – leku podawanego w terapii chorób pomenopauzalnych.4
Ćwiczenie:
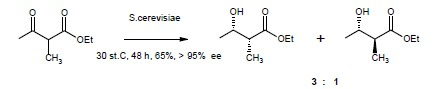
Eksperyment obejmuje redukcję 2-metyloacetylooctanu etylu prowadzącą do mieszaniny (2R,2S) i (2S,3S)-2-metylo-3-hydroksymaślanu etylu w stosunku izomerów 3:15.
Odczynniki:
– 2-metyloacetooctanu etylu 0,5 g (3,85 mmol)
– drożdże piekarnicze Saccharomyces cerevisiae 30 g*
– sacharoza 7,5 g
– woda destylowana 100 ml
– Celite®
– Etanol
– Octan etylu
– MgSO4
Opis ćwiczenia:
– Umieścić drożdże, sacharozę oraz wodę w kolbie stożkowej (500ml), a następnie zatkać wylot kolby watą i umieścić w cieplarce (30-37 oC) na około 20 minut w celu zapoczątkowania fermentacji. Co 3 minuty energicznie wymieszać zawartość kolby.
– 2-Metyloacetooctan etylu rozpuścić w 1ml etanolu i dodać jednorazowo do kolby z fermentującymi drożdżami. Pozostawić w cieplarce w temp. 300C przez 48h **.
– Zakładając odpowiedni stopień przereagowania, reakcję należy przerywać wyciągając kolbę z cieplarki i dodając 2 łyżki celitu (dokładnie wymieszać). Tak przygotowaną mieszaninę pozostawić na ok. 15 min od czasu do czasu mieszając.
– Nastepnie odsącza się zawiesinę drożdży na lejku Büchnera poprzez 3 mm złoże celitu (jeżeli w przesączu są wyraźnie widoczne pozostałości drożdży operację należy powtórzyć). Doprowadzić odczyn przesączu do pH = 7 przy użyciu 2 molowego roztworu NaOH. Tak powstały żółty filtrat poddaje się ekstrakcji octanem etylu (4×60 ml). W przypadku trudności z rozdzielaniem warstw, należy mieszaninę wysolić NaCl lub/oraz odwirować. Zlane ekstrakty organiczne suszy się bezwodnym siarczanem magnezu, przesącza na lejku z sączkiem karbowanym, a przesącz odparowuje w wytarowanej kolbie okrągłodennej na wyparce rotacyjnej do uzyskania żółtej pozostałości produktu (produkt należy zważyć).
– Przebieg reakcji sprawdza się metodą TLC. W tym celu należy pobrać próbkę mieszaniny reakcyjnej i rozcieńczć ją w octanie etylu (C~ 25 mg/ml). Jako układ rozwijający stosuje się mieszaninę eter naftowy – -eter dietylowy 3:1. Jako wzorzec nałożyć roztwór substratu. Płytki obserwuje się pod lampą UV.
– Jeżeli Mieszanina nie zawiera wzorca, tylko produkt obliczyć wydajność teoretyczną i praktyczną reakcji. Literaturowa wydajność wynosi 70% mieszaniny (2R,3S)- i (2S,3S)-2-metylo-3-hydroksymaślanu etylu.
– Surowy produkt można oczyszczać metodą chromatografii kolumnowej. Jako wypełnienie kolumny należy stosowac żel silikonowy, a jako eluent układ eter naftowy-eter dietylowy (3:1).
1.2 Redukcja podwójnego wiązania węgiel- węgiel
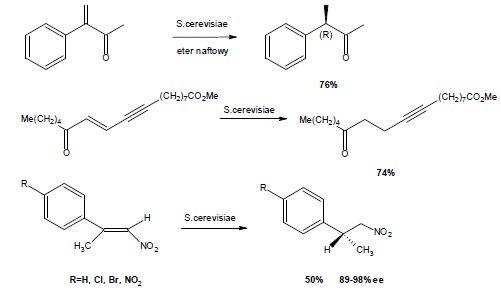
Redukcja wiązań typu C=C z użyciem drożdży jest istotną metodą syntezy chiralnych wielofunkcyjnych syntonów. Po raz pierwszy drożdże do tego celu uzyto już w latach 30 zeszłego stulecia. Istotny wpływ w takim uwodornieniu ma otoczenie wiązania C=C – istotny wpływ ma sąsiedztwo grupy karbonylowej lub wiązania podwójnego z deficytem elektronów bez których to reakcja nie zachodzi. Badania przeprowadzone w latach 70 dowiodły stereoselektywności redukcji z użyciem S. cerevisiae, w których ogólną zasadą była transstereospecyficzna addycja wodoru oraz wprowadzenie wodoru pro-(R) w centrum karbonylowym. Chemoselektywność enzymów drożdżowych została niejednokrotnie potwierdzona. Poniżej przytoczono kilka przykładów6 7:
Redukcję wiązań C=C można rónież osiągnąć poprzez redukcję katalizowaną np. metalami grup przejściowych lub ich tlenkami (Ni Raneya, Pt2O, Pd, itd.) z użyciem gazowego wodoru. Istnieją także metody stosujące np. układy cynk i kwas, sód w etanolu, hydrazynę lub lit i aminę alifatyczną. Zwykle można przeprowadzić tymi metodami selektywną redukcję wiązań C=C (bez naruszenia innych obecnych w substratach grup (np. COOH, CHO, CN, itp.) jednakże wymaga to zastosowania warunków i substratów redukujących charakterystycznych dla danego związku3.
Ćwiczenie:
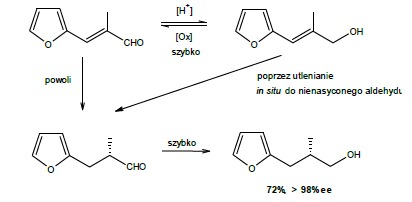
Celem ćwiczenia jest redukcja -metylo- -(2-furylo)akroleiny . Jako produkt otrzymuje się nasycony alkohol. Mechanizm tej reakcji jest trójetapowy : redukcja – utlenianie – redukcja. Wyjściowy aldehyd pozostaje w równowadze z pochodną alkoholu allilowego, przy czym równowaga jest przesunięta w stronę alkoholu. Jednakże już małe (równowagowe) ilości alfa-metylo-beta-(2-furylo)akroleiny ulegają powolnej trans-addycji wodoru w poprzek wiązania podwójnego, do nasyconego aldehydu. Nasycony aldehyd jest wówczas szybko redukowany do nasyconego alkoholu.
Odczynniki:
– alfa-metylo-beta-(2-furylo)akroleina 0,45 g, (0.003 mola)
– drożdże piekarnicze Saccharomyces cerevisiae 12 g*
– glukoza 4.0 g
– woda destylowana 80 ml
– Celite®
– Etanol
– Octan etylu
– MgSO4 bezw.
– nasycony r-r węglanu sodu
– 2M kwas solny
Opis ćwiczenia:
– Umieścić drożdże, glukozę oraz wodę w kolbie stożkowej (500ml), a następnie zatkać wylot kolby watą i umieścić w cieplarce (30-37 oC) na około 45 minut w celu zapoczątkowania fermentacji. Co 5 minut energicznie wymieszać zawartość kolby.
– pH fermentującej mieszaniny powinno być następnie podniesione z 4 do ok. 5.5 poprzez dodanie nasyconego r-ru węglanu sodu (ok.3-4 ml).
– Do tak przygotowanej mieszaniny należy dodać roztwór wyjściowego aldehydu w etanolu (2ml) i delikatnie mieszać w temperaturze pokojowej. Operację należy wykonywać pod wyciągiem.
– Co 12 – 15 godzin należy sprawdzać pH mieszaniny. Ewentualnie w celu obniżenia pH do wartości ok. 5 posłużyć się roztworem kwasu solnego.
– Po ok. 48 h, zakładając wysoki stopień przereagowania, należy przerwać reakcję dodając dwie łyżki celitu **. Mieszaninę pozostawić na ok. 30 min od czasu do czasu mieszając. Następnie odsączyć zawiesinę na lejku ze Büchnera poprzez 3 mm złoże celitu (jeżeli w przesączu są wyraźnie widoczne pozostałości drożdży operację należy powtórzyć). Klarowny, brązowawy filtrat poddaje się ekstrakcji octanem etylu (4 x 70 ml). Zlane ekstrakty octanowe suszy się bezwodnym siarczanem magnezu a następnie przesącza na lejku z sączkiem karbowanym. Przesącz odparowuje się na wyparce rotacyjnej (T = 30 oC), do uzyskania żółtego oleistego produktu. Skład mieszaniny należy skontrolować metodą TLC. Próbkę przygotować wg procedury z poprzedniej syntezy. Jako układ rozwijający stosuje się chlorek metylenu. Płytki obserwu się pod lampą UV przy długości fali 254 nm. Ponieważ aldehyd szybko przechodzi w nienasycony alkohol, na płytce przy Rf~0.38 mogą być widoczne 2 plamy w kształcie ósemki (nasycony i nienasycony alkohol). Świadczy to o niecałkowitym przereagowaniu substratu. Jeżeli obecna jest tylko 1 plamka przy Rf=0.34 – pochodząca od produktu, można uznać całkowite przereagowanie. Wówczas należy obliczyć wydajność teoretyczną oraz praktyczną. (S)-3-(2-Furylo)-2-etylo-1-propanol uzyskuje się z literaturową wydajnością 49%.
– Produkt można oczyszczać metodą chromatografii kolumnowej, używając jako eluenta chlorku metylenu.
*Jeżeli używane są drożdże piekarnicze z pożywką doliczyć ok. 50% masy
**Na tym etapie mieszaninę reakcyjną można zamrozić i przerabiać po kilku dniach.
1 Servi S.; Synthesis 1990, 1-25
2 Kaluzna I., Matsuda T., Sewell A. K., Stewart J. D.; J. Am. Chem. Soc. 2004, 126, 12827-12832.
3 March J.; Chemia Organiczna 1975 WNT Warszawa
4 Crocq V., Masson Ch., Winter J.,Richard Ch., Lemaitre G., Lenay J., Vivat M., Buendia J., Prat D.;Organic Process Research & Development 1997, 1, 2-13
5 Fràter G., Müller U., Günter W, Roberts S.M.(ed.); Preparative Biotransformations. Whole Cells and Isolated enzymes in Organic Synthesis, 1992, 2:1.1, Wiley, London.
6Fuganti C., Griselli S.,Servi S., Hőgberg, Roberts S.M. (ed.); Preparative Biotransformations. Whole Cells and Isolated enzymes in Organic Synthesis, 1992, 2:7.1, Wiley, London.
7 Dumanski P.G., Florey P., Knetting M., Smallridge A.J.; J.Molec.Catal. B: Enzymatic 2001, 11, 905-908.

