PRZEDRUK, oryginał dostępny pod adresem www
Tytuł oryginalny: Analiza Organiczna
Autor: dr Barbara Drożdż
Uniwersytet Jagielloński (www)
Wydział Farmaceutyczny Collegium Medicum (www)
Katedra Chemii Organicznej (www)
Kierownik: Prof. UJ, dr hab. Marek Cegła
Adres:
ul. Medyczna 9
30-688 Kraków
Kontakt: tel. 012 620 55 00
Pierwszym sygnałem obecności układu aromatycznego w badanym związku jest charakterystyczny często bardzo kopcący płomień pojawiający się podczas spalania związku w płomieniu palnika. Ciekłe węglowodory aromatyczne są substancjami lżejszymi od wody i bardzo źle w niej rozpuszczalnymi. Ich temperatury wrzenia wzrastają ze wzrostem masy cząsteczkowej. Poniżej przedstawiono próby pozwalające na stwierdzenie obecności układu aromatycznego w cząsteczce opierające się na charakterystycznych dla tego typu związków reakcjach substytucji elektrofilowej. Należy pamiętać, że reakcje te dają jednoznaczny wynik tylko dla związków należących do grupy rozpuszczalności N, inne związki, a szczególnie związki zawierające aktywne atomy wodoru zachowują się często w tych próbach niespecyficznie.
Chlorek glinu – AlCl3 – jest jasnożółtym związkiem krystalicznym reagującym burzliwie z wodą z wydzieleniem gazowego HCl.
AlCl3 + 6H2O = [Al(H2O)6]Cl3 <=> [Al(H2O)5OH]Cl2 + HCl
Z tego powodu działa silnie drażniąco na drogi oddechowe, a w kontakcie ze skórą działa parząco. Chlorek glinu ze względu na budowę elektronową jest kwasem Lewisa, jego silne własności elektrofilowe są przyczyną wysokiej reaktywności w stosunku do większości związków organicznych).
Próba z chloroformem i chlorkiem glinu
Związki aromatyczne w reakcji Friedla- Craftsa dają barwne pochodne trifenylometanu powstające wg pokazanego poniżej mechanizmu:

Wysoka delokalizacja ładunku ( 10 możliwych struktur kanonicznych) jest odpowiedzialna za absorbcję promieniowania w zakresie światła widzialnego.
Wykonanie – próbę wykonuje się używając dokładnie wysuszonego szkła i szpatelek do nakładania związków. W probówce rozpuszcza się kilka kryształków lub 4 krople badanego związku w około 2 cm3 bezwodnego CHCl3 (lub CC14) i miesza energicznie w celu zwilżenia ścianek. Następnie do ukośnie ustawionej probówki nasypuje się niewielką ilość bezwodnego AlCl3, tak, aby część proszku zatrzymała się na ściankach. Próba polega na obserwacji zmian zabarwienia AlCl3 na ściankach probówki i w roztworze W obecności układów aromatycznych zarówno mono jak i wielopierścieniowych chlorek glinu przyjmuje zabarwienie pomarańczowe, czerwone, niebieskie lub zielone Na ściankach zabarwienie AlCl3 pojawia się często tylko w postaci pojedynczych punktów, których obecność też jest dodatnim wynikiem próby. Jeżeli zabarwienie nie pojawia się natychmiast probówkę należy odstawić na kilka minut. Pozytywny wynik w tej próbie dają często również niearomatyczne związki zawierające brom i jod.
Próba z formaldehydem
Związki aromatyczne w obecności stężonego H2SO4 reagują z formaldehydem z utworzeniem barwnych produktów polimeryzacji. Próba może być wykonana tylko dla związków nierozpuszczalnych w H2SO4.

Wykonanie
0.3 g substancji rozpuszcza się w 1 cm3 heksanu, cykloheksanu lub CCl4 a następnie, dwie krople tego roztworu dodaje się do 1 cm3 świeżo sporządzonego odczynnika formaldehydowego i obserwuje zabarwienie odczynnika po wstrząśnięciu. W obecności węglowodorów aromatycznych roztwór przyjmuje zabarwienie pomarańczowe, różowe, czerwone, zielone lub niebieskie.
Odczynnik formaldehydowy: 1 kroplę formaliny (37-40% roztwór formaldehydu) dodaje się do 1 cm3 stęż. H2SO4 i wstrząsa.
Stałe pochodne dla węglowodorów aromatycznych
– Pochodna nitrowa
Reakcja nitrowania zachodzi dla związków aromatycznych jako substytucja elektrofilowa wodoru jonem nitroniowym NO2+. Do nitrowania używa się mieszaniny nitrującej, reakcja musi być prowadzona w kontrolowany sposób z uwagi na możliwość otrzymania pochodnych z jedną lub większą ilością grup nitrowych. Łatwość z jaką węglowodór ulega reakcji nitrowania i liczba wprowadzonych grup nitrowych zależy od jego budowy.
Wykonanie – reakcję należy wykonać pod digestorium
W kolbie okrągłodennej (50 cm3) do 1 g węglowodoru aromatycznego lub jego fluorowcopochodnej dodaje się 4 cm3 stęż. H2SO4, chłodzi i następnie wkrapla powoli, stale wstrząsając, 4 cm3 stężonego dymiącego HNO3. Kolbę zaopatruje się w chłodnicę zwrotną i pozostawia do ustania egzotermicznej reakcji, a następnie ogrzewa na wrzącej łaźni wodnej przez 15 min. Po ochłodzeniu mieszaninę reakcyjną wlewa się do 25 g drobno potłuczonego lodu. Wytrącony osad odsącza się i przemywa wielokrotnie wodą do zaniku odczynu kwaśnego. W celu oczyszczenia produkt krystalizuje się z 70% etanolu.
– Utlenianie łańcucha bocznego
Węglowodory aromatyczne zawierające jeden łańcuch boczny tworzą w reakcjach utleniania kwasy monokarboksylowe będące ciałami stałymi dobrze nadającymi się do identyfikacji. Należy jednak pamiętać, że wszystkie monopodstawne pochodne alkilowe benzenu dają w wyniku utleniania kwas benzoesowy. Metoda ta jest niekorzystna przy większej ilości łańcuchów bocznych, ponieważ aromatyczne kwasy polikarboksylowe są często nietrwałe. Wyjątek stanowią 1,2- dialkilopochodne, gdyż powstający kwas ftalowy daje się łatwo rozpoznać.
Wykonanie
Do 80 cm3 5% roztworu KMnO4 dodaje się l g badanej substancji i 0.5 g węglanu sodu. Mieszaninę ogrzewa się pod chłodnicą zwrotną od 1 do 4 godz. do zaniku purpurowego zabarwienia nadmanganianu(VII) potasu. Następnie roztwór ochładza się i ostrożnie zakwasza 1 M H2SO4 do odczynu wyraźnie kwaśnego wobec wskaźnika uniwersalnego, a następnie ponownie ogrzewa przez 0.5 godz. i chłodzi w lodzie. Nadmiar KMnO4 usuwa się przez dodatek NaHSO3. Wytrącony osad kwasu odsącza się, przemywa wodą i krystalizuje z wody lub etanolu. Jeżeli osad nie chce się wydzielać można go wyekstrahować eterem, toluenem lub dichlorometanem.
– Kwasy o-aroilobenzoesowe
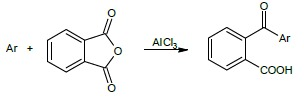
Pochodne o-aroilobenzoesowe powstają z bardzo dobrą wydajnoścoą dla węglowdorów aromatycznych, a trochę gorzej dla ich fluorowcopochodnych.
Wykonanie – reakcję należy wykonać pod digestorium
W kolbie okrągłodennej o pojemności 50 cm3 zaopatrzonej w chłodnicę zwrotną zabezpieczoną przed dostępem wilgoci, umieszcza się 1 g węglowodoru, 10 cm3 osuszonego chlorku metylenu, 2.5 g AlCl3 i 1.5 g bezwodnika kwasu ftalowego. całość ogrzewa się przez 30 min we wrzącej łaźni wodnej a następnie kolbę chłodzi się w lodzie, dodaje 10 cm3 stężonego HCl i wytrząsa przez kilka minut. Do kolby dodaje się 20 cm3 wody w celu rozpuszczenia wszystkich stałych substancji, mieszaninę przenosi się do rozdzielacza i wytrząsa z 25 cm3 eteru. Wodną warstwę (dolną) oddziela się a warstwę eterową (górną) wytrząsa się z 25 cm3 1 M Na2CO3. Warstwę zawierającą sól powstałego kwasu aroilobenzoesowego przenosi się do zlewki i wytrąca kwas dodając 1 M HCl do odczynu kwaśnego. Otrzymany kwas o-aroilobenzoesowy sączy się na lejku Büchnera, przemywa 50 cm3 wody i krystalizuje z rozcieńczonego etanolu.

