PRZEDRUK, oryginał dostępny pod adresem www
Tytuł oryginalny: Analiza Organiczna
Autor: dr Barbara Drożdż
Uniwersytet Jagielloński (www)
Wydział Farmaceutyczny Collegium Medicum (www)
Katedra Chemii Organicznej (www)
Kierownik: Prof. UJ, dr hab. Marek Cegła
Adres:
ul. Medyczna 9
30-688 Kraków
Kontakt: tel. 012 620 55 00
Alkohole są substancjami ciekłymi lub stałymi o temperaturach wrzenia znacznie wyższych niż temperatury wrzenia węglowodorów, halogenków alkilowych i eterów o tej samej liczbie atomów węgla. Wzrost ten spowodowany jest obecnością wiązań wodorowych. Temperatura wrzenia alkoholi rośnie ze wzrostem długości łańcucha a maleje ze wzrostem jego rozgałęzienia.
Niższe alkohole dobrze rozpuszczają się w wodzie, ze względu na hydrofilowe własności grupy wodorotlenowej, w miarę wzrostu długości łańcucha rozpuszczalność maleje z uwagi na hydrofobowe własności części węglowodorowej. Wyższe alkohole i wszystkie alkohole aromatyczne są nierozpuszczalne w wodzie.
Pierwszą informację o możliwości występowania alkoholu w badanej próbce można uzyskać (dla związków ciekłych) obserwując jej zachowanie po dodaniu sodu w procesie stapia (wydzielają się pęcherzyki powstającego wodoru), jest to jednak reakcja niespecyficzna gdyż dają ją również takie związki jak kwasy i fenole, a także związki zanieczyszczone wodą.
W analizie wykorzystuje się różnice w reaktywności alkoholi o różnej rzędowości w reakcjach substytucji nukleofilowej (SN1 i SN2). Zdolność reagowania z odczynnikami nukleofilowymi, a więc i zasadowość, rośnie wraz z rzędowością, natomiast kwasowość maleje.
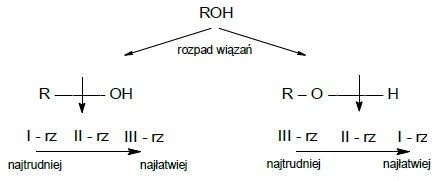
Charakterystyczne, zależne od rzędowości zachowanie alkoholi obserwuje się również w reakcjach utlenienia.
Próba ogólna na obecność alkoholi
próba z metawanadanem amonu i 8-hydroksychinoliną
Mieszanina metawanadanu amonu (NH4VO3) i 8-hydroksychinoliny z alkoholami tworzy połączenia kompleksowe o czerwonym zabarwieniu.
Wykonanie
Do około 1.5 – 2 cm3 badanej substancji dodaje się 0.2 cm3 0.03% wodnego roztworu NH4VO3, a następnie 1-2 kropli 2.5% roztworu 8-hydroksychinoliny w 6% kwasie octowym, całość wstrząsa się i pozostawia na 2 min. Czerwone lub brunatnoczerwone zabarwienie roztworu wskazuje na obecność alkoholu. (Nadmiar odczynników w obecności alkoholu powoduje powstanie prawie czarnego zabarwienia). Alkohol allilowy, benzylowy, glicerol oraz alkohole z grupami aminowymi, fenolowymi i karboksylowymi dają próbę negatywną.
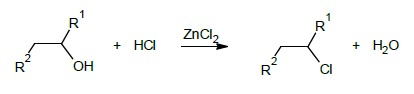
Próba Lucasa na alkohole II- i III-rzędowe
Próba Lucasa wykorzystuje różnice w szybkości reakcji substytucj nukleofilowej alkoholi I, II i III rzędowych, oraz brak rozpuszczalności w wodzie powstających chlorków alkilowych.
Wykonanie
Reakcję prowadzi się w temperaturze pokojowej. Do około 0.2 cm3 badanej substancji dodaje się 2 cm3 odczynnika Lucasa. Po krótkim wstrząsaniu obserwuje się, czy i po jakim czasie powstanie w probówce mlecznobiała emulsja pochodząca od wydzielającego się chlorowcoalkanu. Alkohole III-rzędowe reagują szybko, dając natychmiastowe zmętnienie roztworu, alkohole II-rzędowe reagują wolniej (zmętnienie po ok. 5 min), I-rzędowe nie reagują wcale. Pojawienie się po chwili wyraźnych dwóch warstw (a nie emulsji) sugeruje obecność w próbce związku nierozpuszczalnego w odczynniku Lucasa (np. heksanu) i nie jest dodatnią próbą na alkohole.
Dla potwierdzenia zróżnicowania można wykonać reakcję z kwasem solnym. Do 2 cm3 stężonego HCl dodaje się 3 krople badanego alkoholu – alkohole III-rzędowe dają zmętnienie w ciągu 2-10 min., natomiast alkohole II-rzędowe w tych warunkach nie reagują.
Nietypowo w próbie Lucasa zachowują się alkohole: benzylowy, allilowy i cynamonowy, które mimo tego, że są I-rzędowe, reagują jak III-rzędowe wskutek stabilizacji rezonansowej przejściowego karbokationu.
Odczynnik Lucasa: 32 g bezwodnego. ZnCl2 w 20 cm3 stężonego HCl.
Próba z kwasem nitrochromowym na alkohole I- i II-rzędowe
Mieszanina HNO3 i K2Cr2O7 powoduje utlenienie większości alkoholi I i II-rzędowych, czemu towarzyszy pojawienie się ciemnoniebieskiego lub niebieskozielonego zabarwienia. Alkohole III-rzędowe reakcji tej nie ulegają.
Wykonanie – reakcję należy wykonać pod digestorium
Doświadczenie wymaga ostrożności i ścisłego trzymania się poleceń zawartych w przepisie.
Do 5 cm3 7.5 M HNO3 dodaje się 5 kropli 5% wodnego roztworu K2Cr2O7, a następnie 1 cm3 10% wodnego roztworu badanego związku (nierozpuszczalne w wodzie związki dodaje się bezpośrednio do kwasu nitrochromowego w ilości 0.2 cm3 lub 0.2 g) i starannie wytrząsa. Probówkę pozostawia się pod digestorium na kilka minut. Pojawienie się niebieskiego zabarwienia (w ciągu 5 min) wskazuje na obecność I lub II rzędowego alkoholu. Pozytywny wynik reakcji daje większość związków ulegających reakcji utlenienia.
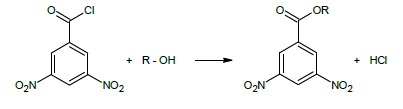
Stała pochodna dla alkoholi
3,5-dinitrobenzoesan (lub p-nitrobenzoesan)
Alkohole reagują z chlorkiem kwasu 3,5-dinitrobenzoesowego z utworzeniem odpowiedniego stałego estru wg reakcji:
Wykonanie
0.5 g chlorku 3,5-dinitrobenzoilu (lub p-nitrobenzoilu) miesza się z 2 cm3 badanego alkoholu i ogrzewa w suchej probówce do łagodnego wrzenia przez 5 min. Czas ogrzewania przedłuża się do 10-30 min dla alkoholi II- i Ill-rzędowych. Następnie wlewa się mieszaninę reakcyjną do 10 cm3 bardzo zimnej wody destylowanej, chłodzi w lodzie i jak najszybciej odsącza. Otrzymany osad przemywa się 10 cm3 2% roztworu NaHCO3, a następnie zimną wodą i krystalizuje z 70% etanolu. Ponieważ otrzymany osad jest łatwo hydrolizującym estrem krystalizację należy przeprowadzić bardzo szybko ograniczając czas ogrzewania estru w etanolu do minimum.

