PRZEDRUK, oryginał dostępny pod adresem www
Instrukcja do ćwiczeń laboratoryjnych
Laboratorium z chemii organicznej
dla kierunku Biotechnologia
Politechnika Śląska (www)
Wydział Chemiczny (www)
Katedra Chemii Organicznej, Bioorganicznej i Biotechnologii (www)
Kierownik Katedry: dr hab. inż. Mirosław Gibas prof. Politechniki Śląskiej
Adres:
ul. B. Krzywoustego 4
44-100 Gliwice
Kolejność wykonywania obliczeń może być następująca:
1. Przeliczyć proporcjonalne ilości substratów stechiometrycznie potrzebne do przeprowadzenia reakcji na 1 mol substancji wyjściowej podanej przez prowadzącego, a następnie na ilość z której faktycznie będzie wykonana synteza. Ilości substancji wyliczyć zarówno w molach (z dokładnością do 0,001 mola) jak i w gramach (z dokładnością do 0,01 g).
Równanie stechiometryczne reakcji i proporcje stechiometryczne substratów na 1 mol chlorku benzylu
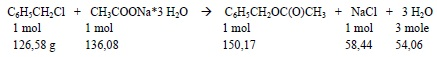
Ponieważ synteza będzie wykonywana z 10 g chlorku benzylu (to znaczy z 10 g/125,58 g/mol = 0,079 mola) więc stechiometrycznie do przeprowadzenia reakcji potrzebne będzie 0,079 mola trójwodnego octanu sodu (tj. 10,75 g). W reakcji, gdyby zaszła stechiometrycznie, można otrzymać po 0,079 mola octanu benzylu i NaCl oraz 0,079*3 = 0,237 moli wody).
2. Wyznaczyć proporcje molowe pomiędzy substratami, produktami reakcji i substancjami pomocniczymi jakie autorzy podali w przepisie. Ilości substancji oblicza się zarówno w molach jak i w gramach, uwzględniając gęstości i procentowe zawartości substancji w roztworach. Uwaga! Stosunki molowe pomiędzy substratami w przepisie często nie odpowiadają stosunkom wynikającym z równania stechiometrycznego. Należy zastanowić się dlaczego!?
Synteza octanu benzylu
Przepis przewiduje użycie następujących ilości substratów:
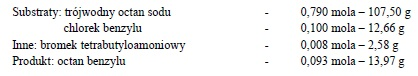
Ponieważ zgodnie z równaniem stechiometrycznym jeden mol chlorku benzylu reaguje z jednym molem octanu sodu więc w reakcji 0,1 mola chlorku benzylu zużyje się co najwyżej 0,1 mola octanu sodu. Pozostała ilość (0,79 mola – 0,1 mola) jest nadmiarem ponad ilość stechiometrycznie potrzebną do reakcji. Nadmiar ten wyrażony w % ilości stechiometrycznie potrzebnej do reakcji wynosi:
[(0,790 mola – 0,100 mola)/0,100 mola]*100% = 690%
Tak duży nadmiar prowokuje w trakcie kolokwium pytanie dlaczego autorzy przepisu zastosowali aż taki nadmiar tego substratu?
W przeciwieństwie do octanu sodu bromek tetrabutyloamoniowy użyty jest w dużym niedomiarze zarówno w stosunku do chlorku benzylu jak też i do ilości powstającego produktu.
Skłania to do myślenia pytania dlaczego w tej syntezie używa się tak mało bromku tetrabutyloamoniowego i jaka jest jego rola w tej syntezie?
3. Przeliczyć proporcjonalnie ilości substancji podanych w przepisie na ilość substancji wyjściowej z której należy wykonać preparat. Preparat będzie wykonany z 10 g chlorku benzylu co stanowi (jak poprzednio wyliczono) 0,079 mola. Aby obliczyć ilość potrzebnego trójwodnego octanu sodu korzystamy z proporcji:
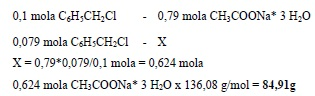
Aby zachować stosunki molowe substratów zakładane w przepisie musimy w reakcji na 0,079 mola tj. 10 g chlorku benzylu użyć 0,624 mola tj. 84,91 g trójwodnego octanu sodu.
Podobnie z proporcji przeliczamy ilości powstających w reakcji produktów. Gdy przepis nie podaje ile produktów ubocznych powstaje, przyjmujemy ilości stechiometryczne.
Analogicznie wyznaczamy ilości używanego w reakcji bromku tetrabutyloamoniowego, jakkolwiek nie występuje on w równaniu stechiometrycznym. Powinniśmy go użyć w ilości 0,006 mola (1,93 g).

