PRZEDRUK, oryginał dostępny pod adresem www
Uniwersytet Gdański (www)
Wydział Chemii (www)
Katedry Chemii Bioorganicznej (www)
Kierownik: Prof. dr hab. Krzysztof Rolka
Adres:
ul. Sobieskiego 18/19
80-952 Gdańsk
Kontakt: tel. 58 52 35 386
____________________________________________________________________________
Fosfataza kwaśna (EC 3.1.3.2) stanowi „enzym znacznikowy” lizosomów, głównego miejsca trawienia wewnątrzkomórkowego. Fosfatazy to grupa enzymów należących do klasy hydrolaz (klasa 3 – obejmuje enzymy katalizujące hydrolityczny rozpad wiązań chemicznych, tabela 1), podklasy enzymów hydrolizujących wiązania estrowe (esterazy), podpodklasy hydrolaz monoestrów fosforanowych.
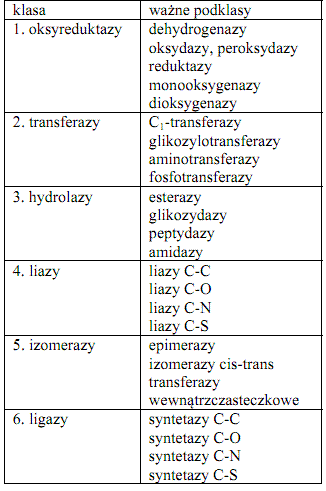
Tabela 1. Klasy enzymów (wg Koolmana i Röhma 2005).
Enzymy te katalizują odszczepienie reszty fosforanowej od cukrów, białek, tłuszczy, nukleotydów i wielu innych występujących w przyrodzie estrów kwasu fosforowego według poniższej reakcji:

Poza naturalnymi substratami, hydrolazy monoestrów fosforanowych rozszczepiają także estry fosforanowe fenoli, np. p-nitrofenylofosforan. Fosfatazy działają w pH alkalicznym, z optymalnym pH w zakresie 9,0 – 11,0, a także w pH kwaśnym i obojętnym, w zakresie 4,5 – 7,0. Te ostatnie są typowe dla komórek roślinnych, chociaż nie brakuje ich także w komórkach zwierzęcych, gdzie występują przede wszystkim w lizosomach, niewielkich błonowych pęcherzykach będących głównym miejscem trawienia wewnątrzkomórkowego.
Lizosomy zawierają specyficzny zestaw hydrolaz, optymalnie aktywnych w środowisku kwaśnym, uczestniczących w rozkładzie organelli komórkowych i wszystkich rodzajów makrocząsteczek dostarczanych do komórki różnymi drogami. Wiodącym enzymem jest tu kwaśna fosfataza uznawana za tzw. „enzym znacznikowy” lizosomów. Kwaśne środowisko światła lizosomu (pH ~ 5) utrzymywane jest dzięki działaniu błonowej H+ -ATPazy, pompującej H+ z cytozolu do wnętrza lizosomu (Rys. 1).
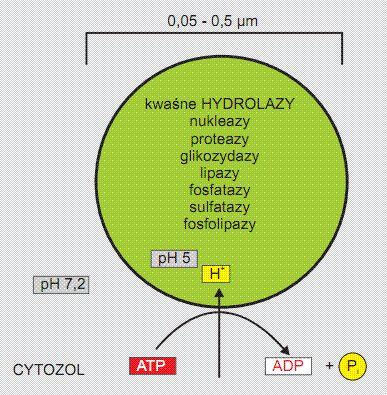
Rys. 1. Schemat lizosomu (wg Albertsa i wsp. 1999)
W obojętnym pH cytoplazmy (pH 7 – 7,3), hydrolityczne enzymy lizosomalne wykazują niską aktywność. Stanowi to przypuszczalnie mechanizm obronny przed samoistnym strawieniem komórki, w przypadku, gdyby enzymy dostały się do cytoplazmy. W komórkach roślin i grzybów rolę lizosomów pełni wakuola komórkowa. Kwaśny odczyn wnętrza wakuoli, istotny dla aktywności występujących tam enzymów hydrolitycznych, utrzymywany jest dzięki działaniu dwóch pomp protonowych (H+ -ATPazy i H+ -PPazy) zlokalizowanych w błonie otaczającej wakuolę, tzw. tonoplaście.
Odczynniki i sprzęt:
1. 50 g Ziemniaków
1. Próbówki szklane
2. Pipety o pojemności 1 mL i 5 mL
3. Statywy do próbówek
4. Łaźnia wodna
5. Spektrofotometr UV-VIS
6. Tarka do ziemniaków
7. Kolba stożkowa 500 mL
8. Lejek Büchnera, sączki
9. 10 mL 0,005 M Roztwóru soli dwusodowej kwasu nitrofenylofosforanowego (przygotować bezpośrednio przed użyciem)
10. 5 mL 0,1 M Buforu cytrynianowego o pH 5,3
11. 15 mL 1 N roztwóru NaOH
12. 10 mL 0,005 M Roztwór p-nitrofenolu w wodzie
Wykonanie doświadczenia:
Izolacja ekstraktu enzymatycznego
Około 50 g obranego i umytego ziemniaka zetrzeć na tarce i przesączyć przez sączek. Wyciąg z ziemniaka odstawić do lodówki lub do łaźni lodowej.
Oznaczanie aktywności enzymatycznej
Do pięciu ponumerowanych próbówek laboratoryjnych odpipetować roztwory według następującego schematu:
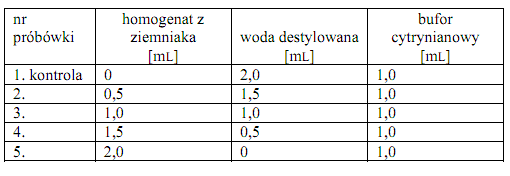
Probówki, po dokładnym wymieszaniu dodanych roztworów, wstawić do łaźni wodnej o temperaturze 37OC na 10 minut. Następnie do każdej próbówki odpipetować szybko po 2 mL 0,005 M roztworu nitrofenylofosforanu sodu o temperaturze 37OC i poddać inkubacji w temperaturze 37OC przez okres podany przez prowadzącego ćwiczenia (od 10-45 minut). Dokładnie po tym czasie do każdej próbówki dodać po 1 mL 1 N roztworu NaOH, wymieszać i przeprowadzić pomiar absorbancji przy długości fali λ = 430 nm wobec wody destylowanej.
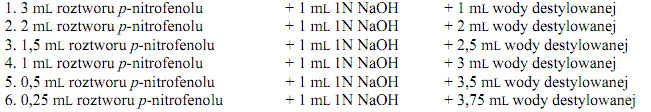
Zmierzyć wartości absorpcji ( przy λ = 430 nm ) roztworów i sporządzić krzywą wzorcową dla pnitrofenolu. Sporządzić wykres odkładając na osi rzędnych µmole zhydrolizowanego substratu/min., a na osi odciętych ilość dodanego homogenatu w mL. Na podstawie uzyskanych wyników obliczyć zawartość enzymu w 1 mL homogenatu z ziemniaka.

