PRZEDRUK, oryginał dostępny pod adresem www
Tytuł oryginalny: Obliczanie wydajności reakcji
Autor: dr Barbara Drożdż
Uniwersytet Jagielloński (www)
Wydział Farmaceutyczny Collegium Medicum (www)
Katedra Chemii Organicznej (www)
Kierownik: Prof. UJ, dr hab. Marek Cegła
Adres:
ul. Medyczna 9
30-688 Kraków
Kontakt: tel. 012 620 55 00
Wydajność reakcji chemicznej (W) jest to stosunek masy produktu (mp) otrzymanej w wyniku przeprowadzenia reakcji chemicznej do masy tego produktu (mt) wynikającej z równania reakcji. Wydajność podaje się w procentach.
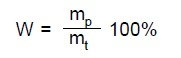
Licząc wydajność reakcji należy zawsze:
– przeliczyć wszystkie ilości związków na gramy lub mole, należy jednak trzymać się jednej wybranej jednostki to znaczy albo wszystko przeliczyć na gramy albo na mole, nie wolno mieszać jednostek,
– jeżeli w reakcji bierze udział więcej niż jeden substrat (czyli prawie zawsze) należy sprawdzić, który z substratów występuje w niedomiarze.
Poniżej podano przykłady obliczeń wydajności reakcji posługując się ilościami substancji wyrażonymi w gramach. Obliczenia można prowadzić również posługując się ilościami wyrażonymi w molach w takich wypadkach należy podawać ilości w molach z dokładnością do trzeciego miejsca znaczącego.
Przedstawiając obliczenia wydajności reakcji należy pamiętać o podawaniu jednostek i opisie jakiego związku dana wartość dotyczy.
Przykład 1
Oblicz wydajność reakcji utleniania 3g toluenu nadmiarem KMnO4 w środowisku kwaśnym jeżeli w jej wyniku otrzymano 2.5 g kwasu benzoesowego.
Odpowiedź:
Odpowiednie masy molowe wynoszą:
toluen – 92 g/mol
kwas benzoesowy – 122 g/mol
Równanie tej reakcji ma postać:
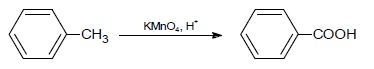
W tym przykładzie nie wyznaczamy, który reagent występuje w niedomiarze, ponieważ informacja ta została podana w temacie zadania.
Ze stechiometrii reakcji wynika, że z jednego mola toluenu powstaje jeden mol kwasu czyli z:
92 g toluenu – 122 g kwasu benzoesowego
3 g toluenu – x g kwasu benzoesowego
Rozwiązując proporcję otrzymuje się, że:
x = 3.98 g – tyle kwasu powinno powstać przy 100% wydajności reakcji
Ponieważ w reakcji otrzymano 2.5 g kwasu benzoesowego wydajność przeprowadzonej reakcji wynosiła:
2.5 g/3.98 g x 100 % = 62.8 %
Przykład 2
Oblicz wydajność reakcji 4 g benzaldehydu z 0.4 g hydrazyny jeżeli w jej wyniku otrzymano 2 g azyny.
Reakcja zachodzi zgodnie z równaniem:
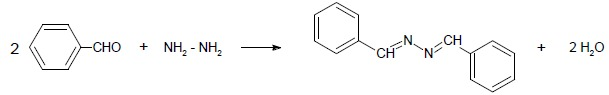
Odpowiedź:
Odpowiednie masy molowe wynoszą:
benzaldehyd – 106 g/mol
hydrazyna – 32 g/mol
azyna – 208 g/mol
W reakcji biorą udział dwa substraty, w związku z tym konieczne jest obliczenie, który z substratów występuje w niedomiarze, gdyż to jego ilość decyduje o wydajności reakcji.
Z reakcji stechiometrycznej wynika, że 2 mole benzaldehydu reagują z 1 molem hydrazyny.
Zatem zgodnie z równaniem stechiometrycznym:
2 x 106 g benzaldehydu – 32 g hydrazyny
4 g benzaldehydu – x g
x = 0.6 g hydrazyny
Z powyższych obliczeń wynika, że zgodnie ze stechiometrią 4 g benzaldehydu reaguje z 0.6 g hydrazyny, ponieważ w reakcji użyto 0.4 g hydrazyny – hydrazyna została użyta w niedomiarze wobec tego niecały benzaldehyd uległ przemianie.
Wydajność reakcji liczy się względem substratu użytego w niedomiarze. W tym wypadku względem hydrazyny.
Z równania reakcji wynika, że z 1 mola hydrazyny powstaje 1 mol azyny czyli:
32 g hydrazyny – 208 g azyny
0.4 g hydrazyny – x g azyny
x = 2.6 g – tyle azyny powinno powstać przy 100% wydajności reakcji
Ponieważ w reakcji otrzymano 2 g azyny, wydajność przeprowadzonej reakcji wynosiła:
2 g/2.6 g x 100 % = 76.9 %
Przykład 3
Oblicz wydajność reakcji 4.2 cm3 aldehydu octowego z 2 cm3 aniliny jeżeli w jej wyniku otrzymano 2.1 g zasady Schiffa.
Reakcja zachodzi zgodnie z równaniem:

Odpowiedź:
Uwaga: Dodatkowym problemem w tym zadaniu są ilości substratów podane w cm3, które należy przeliczyć na gramy w oparciu o gęstości związków.
Z definicji gęstość jest stosunkiem masy do objętości, jednostką gęstości jest g/cm3. Odpowiednie masy molowe wynoszą:
acetaldehyd – 44 g/mol
anilina – 93 g/mol
zasada Schiffa – 119 g/mol
Odczytane z tablic fizykochemicznych gęstości wynoszą:
dacetaldehydu = 0.79 g/cm3
daniliny = 1.02 g/cm3
Przeliczenie podanych objętości na masy:
z gęstości acetaldehydu wynika 0.79 g – 1 cm3
x g – 4.2 cm3
czyli 4.2 cm3 acetaldehydu odpowiadają masie x = 3.32 g
z gęstości aniliny wynika 1.02 g – 1 cm3
x g – 2 cm3
czyli 2 cm3 aniliny odpowiadają masie x = 2.04 g
Zadanie należy zacząć od obliczenia, którego ze związków użyto w niedomiarze:
44 g acetaldehydu – 93 g aniliny
3.32 g acetaldehydu – x g aniliny
x = 7.02 g aniliny
W tej reakcji w niedomiarze występuje anilina, której użyto tylko 2.04 g zamiast 7.02 g.
Obliczenie wydajności:
93 g aniliny – 119 g zasady Schiffa
2.04 g aniliny – x g zasady Schiffa
x = 2.6 g zasady Schiffa – tyle powinno powstać przy 100% wydajności
Wydajność:
2.1 g/2.6 g x 100 % = 80.5 %
Przykład 4
Obliczyć wydajność reakcji 15 cm3 2,3-dimetylobutan-2-olu z 40 cm3 stężonego kwasu solnego zachodzącej zgodnie z równaniem:

jeżeli w jej wyniku otrzymano 18 cm3 2-chloro-2,3-dimetylobutanu.
(Gęstość alkoholu dalkoholu = 1.42 g/cm3, gęstość chlorku alkilowego dchlorku = 1.1 g/cm3, stężony HCl jest 36%, dHCl = 1.18 g/cm3)
Odpowiedź:
Odpowiednie masy molowe wynoszą:
2,3-dimetylobutan-2-ol – 102 g/mol
2-chloro-2,3-dimetylobutan – 120.5 g/mol
HCl – 36.5 g/mol
Przeliczenie podanych objętości na masy:
Z gęstości 2,3-dimetylobutan-2-olu wynika, że
1.42 g – 1 cm3
x – 15 cm3
x = 21.3 g alkoholu użyto w reakcji
W reakcji użyto 30 cm3 stężonego roztworu HCl, w związku z tym należy obliczyć ile HCl znajdowało się w tej ilości.
Jak podano w temacie zadania stężony HCl jest 36% a jego gęstość wynosi dHCl = 1.18 g/cm3. Na podstawie tych informacji obliczamy:
Z gęstości kwasu solnego wynika, że
1.18 g – 1 cm3
x – 40 cm3
w reakcji użyto x = 47.2 g 36% HCl
Ze stężenia procentowego HCl wynika, że:
100 g roztworu HCl – 36 g HCl
47.2 g roztworu HCl – x
x = 17 g HCl
Z równania reakcji wynika, że
102 g alkoholu – 36.5 g HCl
21.3 g alkoholu – x
x = 7.6 g HCl
W tej reakcji w niedomiarze występuje alkohol, bo jak wynika z powyższych obliczeń na użytą ilość alkoholu powinno przypadać tylko 7.6 g HCl a kwasu użyto 17 g.
Obliczenie wydajności:
102 g alkoholu – 120.5 g chlorku alkilowego
21.3 g alkoholu – x
x = 25.16 g chlorku alkilowego – tyle powinno powstać przy 100% wydajności
W reakcji otrzymano 18 cm3 chlorku co należy na podstawie gęstości przeliczyć na gramy:
1.1 g – 1 cm3
x – 18 cm3
x = 19.8 g – tyle gramów chlorku otrzymano
Wydajność:
19.8 g/25.16 g x 100 % = 78.7 %

